题目内容
【题目】[化学-选修3:物质结构与性质]
硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是_________________。
(2)①硫单质的一种结构为![]() ,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。
,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。
②SO42-、CS2、CO32-键角由大到小的顺序是_________________。
(3)含硫的物质的特殊性质与其结构相关。
①熔点:SF6 _______A1F3(填“>”或“<”),原因是___________________。
②分析并比较![]() 与
与![]() 的沸点高低:___________________。
的沸点高低:___________________。
(4)ZnS晶胞如图所示:

①由图可知,Zn2+填在了S2-形成的______________空隙中。
②已知晶胞密度为,![]() g/cm3,阿伏加德罗常数为NA,则晶胞边长为__________pm。
g/cm3,阿伏加德罗常数为NA,则晶胞边长为__________pm。
【答案】![]() sp3杂化难溶范德华力共价键CS2>
sp3杂化难溶范德华力共价键CS2>![]() >
>![]() <SF6是分子晶体,AlF3是离子晶体,离子晶体的熔点高于分子晶体
<SF6是分子晶体,AlF3是离子晶体,离子晶体的熔点高于分子晶体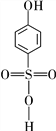 沸点更高,因为形成分子间氢键正四面体
沸点更高,因为形成分子间氢键正四面体![]()
【解析】
(1)硫的核电荷数为16,基态硫原子的电子排布式为1s22s22p63s23p4,则其价层电子排布图是![]() ;
;
(2)①在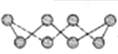 分子中每个硫原子与两个硫原子形成共价键,另外硫原子还有2个未成键电子对,则其杂化方式为sp3杂化,该分子内只存在非极性共价键,为非极性分子,难溶于极性溶剂水中,该晶体中存在的作用力分子间作用力和、共价键(或非极性共价键);
分子中每个硫原子与两个硫原子形成共价键,另外硫原子还有2个未成键电子对,则其杂化方式为sp3杂化,该分子内只存在非极性共价键,为非极性分子,难溶于极性溶剂水中,该晶体中存在的作用力分子间作用力和、共价键(或非极性共价键);
②SO42-中硫原子为sp3杂化、CS2中碳原子为sp杂化、CO32-中碳原子为sp2杂化,则三者键角由大到小的顺序是CS2>CO32->SO42-;
(3)①SF6是分子晶体,AlF3是离子晶体,离子晶体的熔点高于分子晶体,即熔点SF6>_A1F3;
②![]() _分子间能形成氢键,而
_分子间能形成氢键,而![]() 只能形成分子内氢键,则
只能形成分子内氢键,则![]() 沸点更高;
沸点更高;
(4)①由图可知,Zn2+周围最靠近的4个S2-形成正四面体结构,Zn2+填在了S2-形成的正四面体空隙中;
②设晶胞的边长为xcm,则晶胞体积为x3cm3,晶胞中含有ZnS的数目应该是4个,则NA个晶胞的质量为4×87g,晶胞的密度=(4×87g)÷(NA×x3cm3)=![]() g/cm3,解题x=_
g/cm3,解题x=_![]() =_
=_![]() pm。
pm。