题目内容
16.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 原子得电子能力强弱:W<X<Y<Z | |
| D. | T元素的单质可能具有半导体的特性,T与Z元素可形成化合物TZ4 |
分析 W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,令W的最外层电子数为a,则X、Y、Z最外层电子数分别为a+1、a+2、a+3,故a+a+1+a+2+a+3=22,解得a=4,故W为Si、X为N、Y为O、Z为Cl、T为Ge,据此解答.
解答 解:W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,令W的最外层电子数为a,则X、Y、Z最外层电子数分别为a+1、a+2、a+3,故a+a+1+a+2+a+3=22,解得a=4,故W为Si、X为N、Y为O、Z为Cl、T为Ge,
A.X、Y、Z三种元素最低价氢化物分别为氨气、水、HCl,常温下水为液态,氨气、HCl为气体,故水的沸点最高,氨气分子之间都存在氢键,沸点比HCl的高,故A错误;
B.N、O和H形成的化合物硝酸铵中既有离子键、又有共价键,故B错误;
C.元素的非金属性越强,其得电子能力越强,由于非金属性Y>Z>X>W,故得电子能力Y>Z>X>W,故C错误;
D.Ge元素的单质具有半导体的特性,与Cl元素可形成化合物GeCl4,故D正确,
故选D.
点评 本题主要考查结构性质位置关系应用,推断元素是解题关键,注意A中氢键对物质性质的影响,难度中等.

练习册系列答案
相关题目
6.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )
| A. | 吸氢材料镧镍合金 | B. | 半导体材料砷化镓 | ||
| C. | 高温结构陶瓷材料氮化硅 | D. | 透明陶瓷材料硒化锌 |
4.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X与W同主族,Z是地壳中含量最高的元素.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | X和Y两元素一定不在同一周期 | |
| C. | 元素Z、W的简单离子的电子层结构相同 | |
| D. | X、W两元素一定能形成两种组成不同的氧化物 |
11.化学中有“四同”,根据“四同”的概念,下列物质间关系正确的是( )
| A. | 1H2、2H2--同位素 | B. | HCOOCH3、CH3OCHO--同分异构体 | ||
| C. | S2-、S22---同素异形体 | D. | 甲基丙烯酸、油酸--同系物 |
8.设NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 常温常压下,2.8gN2与C2H4的混合气体中含有的电子数为1.4NA | |
| B. | 标准状况下,1.12L NO与1.12LO2的混合物中含有的原子数为0.2NA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| D. | 常温下,1L0.1mol•L-1的NH4NO3溶液中氧原子数为0.3NA |
5.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol苯中含有3nA个碳碳双键 | |
| B. | 标准状况下,22.4 L乙烯和丙烯混合气体中所含的分子数目为2nA | |
| C. | 1mol Cl2与足量Fe粉反应生成FeCl3,转移2nA个电子 | |
| D. | 1L 0.1 mol•L-1 Na2S溶液中含有0.1nA个S2- |
6.在固定容积的密闭容器中,可逆反应2X(g)+2Y(s)?3Z(g),达到平衡后,若将容器中X、Y、Z的物质的量均减少一半,对该反应产生的影响是( )
| A. | 正、逆反应速率都减小,平衡不移动 | |
| B. | 正、逆反应速率都减小,平衡向正反应方向移动 | |
| C. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
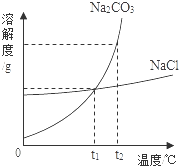 我国化学家侯德榜创立的侯氏制碱法,就是以海水晒盐得到的氯化钠为原料,制得纯碱碳酸钠,碳酸钠和氯化钠的溶解度曲线如图所示,试回答下列问题:
我国化学家侯德榜创立的侯氏制碱法,就是以海水晒盐得到的氯化钠为原料,制得纯碱碳酸钠,碳酸钠和氯化钠的溶解度曲线如图所示,试回答下列问题: