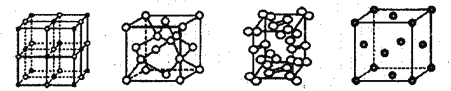
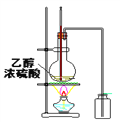
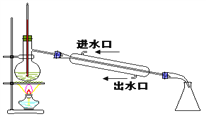
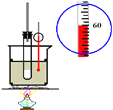
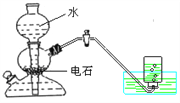
题目内容
【题目】如图,下列关于新型镁锂双离子二次电池的说法不正确的是
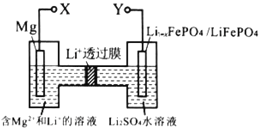
A.充电时,外加电源的正极与 Y 相连
B.充电时,导线上每通过 lmole—,理论上左室电解液质量减轻12 g
C.放电时,Li十由左向右移动
D.放电时,正极的电极反应式为 Li1- xFePO4 +xLi ++xe—=LiFePO4
【答案】B
【解析】
放电时,左边镁为负极失电子发生氧化反应,反应式为Mg-2e-=Mg2+,右边为正极得电子发生还原反应,反应式为![]() ,电解质溶液中锂离子透过锂离子交换膜移向正极;充电时,外加电源的正极与正极相连,阳极上LiFePO4失电子发生氧化反应,负极与负极相连,结合电子转移进行计算解答。
,电解质溶液中锂离子透过锂离子交换膜移向正极;充电时,外加电源的正极与正极相连,阳极上LiFePO4失电子发生氧化反应,负极与负极相连,结合电子转移进行计算解答。
A. 左边镁失电子、为负极,右边电极上得电子、发生还原反应、为正极,即X为负极接线柱、Y为正极接线柱,充电时,外加电源的正极与电池正极相连,负极与电池负极相连,故A正确;
B. 充电时,导线上每通过1mole,左室得电子发生还原反应,反应式为![]() ,但右侧将有1molLi+移向左室,所以溶液质量减轻127=5g,故B错误;
,但右侧将有1molLi+移向左室,所以溶液质量减轻127=5g,故B错误;
C. 放电时,电解质溶液中锂离子透过锂离子交换膜移向正极,即放电时,Li+由左向右移动,故C正确;
D. 右边为正极、得电子、发生还原反应,电极反应式为![]() ,故D正确;
,故D正确;
故答案选:B。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g)![]() HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
反应II:CH3OH(g)+1/2O2(1)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
反应III:H2(g)+1/2O2(g)![]() H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
副反应:
反应IV:CH3OH(g)+O2(g)![]() CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
(1)计算反应Ⅱ的反应热△H2=____________________________________________。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g)![]() HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(3)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH3OH→H+·CH2OH
历程ⅱ:·CH2OH→·H+HCHO
历程ⅲ:·CH2OH→3·H+CO
历程iv:·H+·H→H2
下图表示一定条件下温度对碳酸钠催化脱氢性能的影响,回答下列问题:

①从平衡角度解析550℃-650℃甲醇生成甲醛的转化率随温度升高的原因___________;
②反应历程i的活化能___________(填“>、“<”或“=”)CH3OH(g)![]() HCHO(g)+H2(g)活化能。
HCHO(g)+H2(g)活化能。
③650℃~750℃,反应历程ii的速率___________(填“>”、“<”或“=”)反应历程ⅲ的速率。
(4)吹脱是处理甲醛废水的一种工艺,吹脱速率可用方程v=0.0423c(mg·L-1·h-1)表示(其中c为甲醛浓度),下表为常温下甲醛的浓度随吹脱时间变化数据。
浓度(mg/L) | 10000 | 8000 | 4000 | 2000 | 1000 |
吹脱时间(h) | 0 | 7 | 23 | 39 | 55 |
则当甲醛浓度为2000mg/L时,其吹脱速率v=___________ mg·L-1·h-1,分析上表数据,起始浓度为10000mg/L,当甲醛浓度降为5000mg/L,吹脱时间为___________h。