题目内容
【题目】T℃时,纯水的pH约为6.5。该温度下,0.01mol·L-1HA溶液中c(H+)/c(OH-)=105,向10mL该溶液中逐滴加入0.01 mol·L- 1MOH溶液(已知MOH的电离平衡常数Kb=1.8×10-5),在滴加过程中,下列有关叙述中正确的是
A. HA的电离平衡常数为Ka=1.0×10-7
B. 当滴加10 mLMOH溶液时,所得溶液呈酸性
C. 当滴入20 mL MOH溶液时,溶液中有:c(MOH)+2c(OH-)=c(A-)+c(H+)+2c(HA)
D. 当滴入少量的MOH溶液时,促进了HA的电离,溶液的pH升高,且随着MOH量的增加c(A-)/c(HA)的值增大
【答案】D
【解析】T℃ 时,纯水的pH约为6.5。该温度下,Kw=1.0×10-13。A. 0.01mol·L-1HA溶液中c(H+)/c(OH-)=105=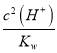 =
=![]() ,因此c(H+)=1.0×10-4,则HA的电离平衡常数为Ka=
,因此c(H+)=1.0×10-4,则HA的电离平衡常数为Ka=![]() =
=![]() ×10-4,故A错误;B. 当滴加10 mLMOH 溶液时,所得溶液中含有MA,根据二者的电离平衡常数,该盐属于强碱弱酸盐,所得溶液呈碱性,故B错误;C. 当滴入20 mL MOH 溶液时,所得溶液中含有等物质的量的MA和MOH,根据质子守恒,溶液中有:c(MOH)+2c(OH-)=2c(H+)+c(M+),很显然,c(H+)+c(M+)≠c(A-)+2c(HA),故C错误;D. HA为弱酸,当滴入少量的MOH溶液时,溶液中的c(H+)减小,溶液的pH升高,促进HA的电离,c(A-)增大,c(HA)减小, c(A-)/c(HA)的值增大,故D正确;故选D。
×10-4,故A错误;B. 当滴加10 mLMOH 溶液时,所得溶液中含有MA,根据二者的电离平衡常数,该盐属于强碱弱酸盐,所得溶液呈碱性,故B错误;C. 当滴入20 mL MOH 溶液时,所得溶液中含有等物质的量的MA和MOH,根据质子守恒,溶液中有:c(MOH)+2c(OH-)=2c(H+)+c(M+),很显然,c(H+)+c(M+)≠c(A-)+2c(HA),故C错误;D. HA为弱酸,当滴入少量的MOH溶液时,溶液中的c(H+)减小,溶液的pH升高,促进HA的电离,c(A-)增大,c(HA)减小, c(A-)/c(HA)的值增大,故D正确;故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】物质A~E均含同种元素,都是中学化学中常见的物质,C为蓝色不溶于水的固体,它们可发生如下图所表示的反应(除A~E外的其他物质已略去):

(1)写出相应物质的类别:
物质 | B | C | D |
类别 | ___________ | ______________ | ______________ |
(2)在以上反应中(用序号填空):
属于氧化还原反应的是________;属于复分解反应的是________。
(3)写出反应③和⑦的离子方程式:_______________________。

