题目内容
9.某合作学习小组讨论辨析以下说法,其中正确的是( )①粗盐和酸雨都是混合物
②沼气和水煤气都是可再生能源
③冰和干冰既是纯净物又是化合物
④不锈钢和目前流通的硬币都是合金
⑤纯碱和熟石灰都是碱
⑥豆浆和雾都是胶体.
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥ | D. | ①③④⑥ |
分析 ①混合物是由多种物质组成的物质;
②能够源源不断的从自然界得到补充的能源叫可再生能源;
③纯净物是由一种物质组成的物质,化合物是由不同种元素组成的纯净物;
④合金是由两种或两种以上的金属与非金属经一定方法所合成的具有金属特性的物质;
⑤纯碱属于盐,熟石灰属于碱;
⑥分散质粒子直径在1nm~100nm之间的分散系属于胶体.
解答 解:①粗盐含有杂质和酸雨中溶有二氧化硫都是混合物,故①正确;
②沼气是由发酵产生的,属于可再生能源,但水煤气是由煤和水高温反应的产物,则是不可再生能源,故②错误;
③冰和干冰都是由一种物质组成的物质,是纯净物,都是由不同种元素组成的纯净物,又是化合物,故③正确;
④不锈钢和目前流通的硬币都是由两种或两种以上的金属组成的,是合金,故④正确;
⑤纯碱是由钠离子和碳酸根离子组成的化合物,属于盐;熟石灰属于碱,故⑤错误;
⑥豆浆、雾、烟分散质粒子直径在1nm~100nm之间,是胶体,故⑥正确,
故选D.
点评 本题考查物质的分类,难度不大,熟悉物质的分类及常见的概念即可解答,平时注意知识的积累.

练习册系列答案
相关题目
19.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 26g乙炔所含共用电子对数目为3NA | |
| C. | 标准状况下,11.2 L CCl4所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
20.下列有关化学用语表示正确的( )
| A. | N2的电子式:N??N | |
| B. | S2-的结构示意图: | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | 苯的最简式:C6H6 |
17.能说明苯分子中没有单双键存在,且分子为平面正六边形结构的依据是( )
| A. | 苯分子的核磁共振图表明分子中只存在一种氢原子 | |
| B. | 邻二甲苯没有同分异构体 | |
| C. | 间二甲苯没有同分异构体 | |
| D. | 对二甲苯没有同分异构体 |
4.实验室中,要使AlCl3溶液中的Al3+离子全部沉淀出来,最适宜用的试剂是( )
| A. | 氨水 | B. | Ba(OH)2 溶液 | C. | 盐酸 | D. | NaOH溶液 |
1.高纯MnCO3是制备高性能磁性材料的主要原料.某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):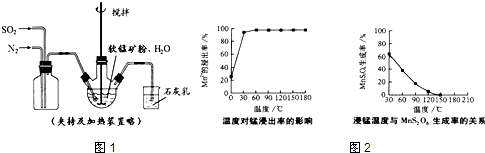
①缓慢向烧瓶中(见图1)通入过量混合气进行“浸锰”操作,主要反应原理为:SO2+H2O=H2SO3;MnO2+H2SO3=MnSO4+H2O(铁浸出后,过量的SO2会将Fe3+还原为Fe2+)
②向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末.
③再用Na2CO3溶液调节pH为3.5左右,过滤.
④调节滤液pH为6.5~7.2,加入NH4HCO3,有无色无味的气体放出,同时有浅红色的沉淀生成,经过滤、洗涤、干燥,得到高纯碳酸锰.请回答:
(1)石灰乳参与反应的化学方程式为Ca(OH)2+SO2═CaSO3+H2O.
(2)“浸锰”反应中往往有副产物MnS2O6的生成,温度对“浸锰”反应的影响如图2,为减少MnS2O6 的生成,“浸锰”过程适宜的温度是150℃(或150℃以上).
(3)查阅下表回答②中加入一定量纯MnO2粉末的主要作用是将Fe2+氧化为Fe3+,将过量的SO2氧化除去.
(4)③中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4溶液.用平衡移动原理解释加入MnS的作用MnS(S)?Mn2+(aq)+S2-(aq)、S2-(aq)+Cu2+(aq)?CuS(S)生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去.
(5)④中加入NH4HCO3后发生反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(6)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解.请问用少量C2H5OH洗涤的原因是防止MnCO3潮湿时被空气氧化、便于在温度低于100℃干燥等.

①缓慢向烧瓶中(见图1)通入过量混合气进行“浸锰”操作,主要反应原理为:SO2+H2O=H2SO3;MnO2+H2SO3=MnSO4+H2O(铁浸出后,过量的SO2会将Fe3+还原为Fe2+)
②向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末.
③再用Na2CO3溶液调节pH为3.5左右,过滤.
④调节滤液pH为6.5~7.2,加入NH4HCO3,有无色无味的气体放出,同时有浅红色的沉淀生成,经过滤、洗涤、干燥,得到高纯碳酸锰.请回答:
(1)石灰乳参与反应的化学方程式为Ca(OH)2+SO2═CaSO3+H2O.
(2)“浸锰”反应中往往有副产物MnS2O6的生成,温度对“浸锰”反应的影响如图2,为减少MnS2O6 的生成,“浸锰”过程适宜的温度是150℃(或150℃以上).
(3)查阅下表回答②中加入一定量纯MnO2粉末的主要作用是将Fe2+氧化为Fe3+,将过量的SO2氧化除去.
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(5)④中加入NH4HCO3后发生反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(6)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解.请问用少量C2H5OH洗涤的原因是防止MnCO3潮湿时被空气氧化、便于在温度低于100℃干燥等.
8.我国古代的各种技术中,其工作原理不涉及化学反应的是( )
| A. | 使用火药 | B. | 用粮食酿酒 | C. | 用纺线车纺线 | D. | 铁的冶炼 |
6.下列叙述中,正确的是( )
| A. | 相对分子质量相同、结构不同的化合物一定互为同分异构体 | |
| B. | 含不同碳原子数的烷烃一定互为同系物 | |
| C. | 结构对称的烷烃,其一氯取代产物必定只有一种 | |
| D. | 分子通式相同且组成上相差一个或几个CH2原子团的物质互为同系物 |