题目内容
【题目】工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl,用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A. 标准状况下,0.2 mol/L 的BaCl2溶液中含有的Cl-数目为0.4NA
B. 生成2.33 g BaSO4沉淀时,吸收SO2的体积约为 0.224 L
C. 常温常压下,17 g H2O2中所含分子总数为 0.5NA
D. 标准状况下,每转移1 mol电子,消耗1 mol H2O2
【答案】C
【解析】
A.没有告诉该氯化钡溶液体积,题中条件无法计算溶液中氯离子的物质的量及数目,故A错误;
B. 2.33 g BaSO4的物质的量为![]() =0.01mol,生成0.01mol BaSO4沉淀时,吸收SO2的物质的量为0.01mol,由于没有指明标况下,无法计算其体积,故B错误;
=0.01mol,生成0.01mol BaSO4沉淀时,吸收SO2的物质的量为0.01mol,由于没有指明标况下,无法计算其体积,故B错误;
C. 17 g H2O2的物质的量为![]() =0.5mol,所含分子总数为 0.5NA,故C正确;
=0.5mol,所含分子总数为 0.5NA,故C正确;
D.由方程式SO2+H2O2+BaCl2=BaSO4↓+2HCl可知,每转移2 mol电子,消耗1 mol H2O2,故D错误。
答案选C。

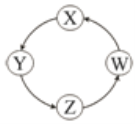
【题目】图示表示物质X、Y、Z、W在一定条件下可以按照箭头一步转化。
序号 | X | Y | Z | W |
|
(1) | |||||
(2) |
|
| |||
(3) |
|
|
(1)X是金属单质,焰色反应呈黄色;Y的纯净物易潮解;Z可用于治疗胃酸过多;X在黄绿色的气体中燃烧可以产生白烟W(已知:电解熔融态的W可以得到X)。
X是:___________Y是:___________Z是:__________W是:__________(填写化学式)
(2)Z具有漂白性,但是不稳定,易分解产生含氯化合物。Z是:________(填写化学式)
(3)鉴别X、Y可以滴加___________溶液,前者出现血红色。(填写名称)