题目内容
【题目】根据方程式所表示的氧化还原反应设计一个原电池:Fe + H2SO4 = H2↑+ FeSO4
(1)装置采用烧杯和盐桥,画出此原电池的装置图______________
(2)指出原电池的正极材料和负极材料并标出电子的流向:正极材料_________,负极材料________ ,电子的流向_________
(3)写出两个电极上的电极反应并指出现象:负极反应 ___________ 、现象___________正极反应___________、现象_________________
(4)转移的电子数为2NA时,生成的H2在标准状况下的体积为________________
【答案】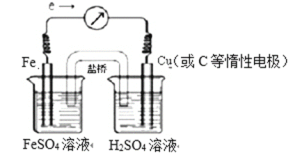 Cu或C等 Fe 由Fe经外电路流向铜(或C) Fe -2e- = Fe2+ 铁极变细 2H+ +2e- = H2 产生无色无味的气体 22.4L
Cu或C等 Fe 由Fe经外电路流向铜(或C) Fe -2e- = Fe2+ 铁极变细 2H+ +2e- = H2 产生无色无味的气体 22.4L
【解析】
(1)根据电池反应式知,该反应中铁失电子发生氧化反应,作负极,因为有盐桥,正极可以是铜或碳等惰性电极,铁电极对应的溶液为可溶性的亚铁盐溶液,一般使用硫酸亚铁溶液,正极的电解液为硫酸,装置图为:

(2)负极为Fe,正极为Cu或C,负极: Fe- 2e- =Fe2+,正极:2H+ + 2e- =H2↑,外电路中,电子从铁流向铜(或C等惰性电极),
答案为:Cu或C等;Fe;由Fe经外电路流向铜(或C);
(3)负极失电子,发生氧化反应,负极反应: Fe- 2e- =Fe2+,实验现象为铁极变细;正极得电子发生还原反应,正极反应:2H+ + 2e- =H2↑,实验现象产生无色无味的气体,
答案为:Fe -2e- = Fe2+;铁极变细;2H+ 2e- = H2;产生无色无味的气体;
(4)根据电极反应2H+ + 2e- =H2↑,转移的电子数为2NA时,即转移2mol电子时,生成1mol氢气,则1mol气体在标况下的体积为22.4L,
答案为:22.4L;

 备战中考寒假系列答案
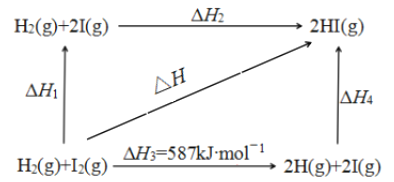
备战中考寒假系列答案【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下:2CH4(g)C2H4(g)+2H2(g) ΔH>0
化学键 | H—H | C—H | C=C | C—C |
E(kJ/mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=____________ (用含a、b、c、d的代数式表示)。
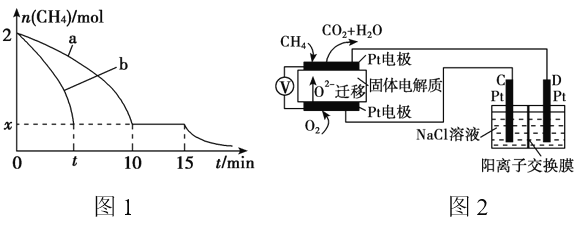
(2)T1温度时,向1 L的恒容反应器中充入2mol CH4 ,仅发生上述反应,反应过程中 0~15min CH4的物质的量随时间变化如图1,测得10~15min时H2的浓度为1.6mol/L。
①0~10min内CH4表示的反应速率为__________mol/(L·min)。
②若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填“a”或 “b”)。
③15min时,若改变外界反应条件,导致n(CH4)发生图1中所示变化,则改变的条件可能是_____________________________________(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2)其中k正、k逆为速率常数仅与温度有关,T1温度时k正与k逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正____v逆(填“>”“=”或“<”),判断的理由是_________________ 。
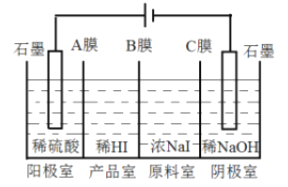
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-。
①C极的Pt为______ 极(填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112mL,则阴极区所得溶液在25℃时pH=_______ (假设电解前后NaCl溶液的体积均为500mL)。