题目内容
汽车尾气净化中的一个反应如下:2NO(g)+2CO(g) N2(g)+2CO2(g)ΔH=-746.8 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化,符合图中曲线的是( )
N2(g)+2CO2(g)ΔH=-746.8 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化,符合图中曲线的是( )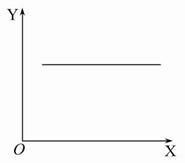
| A.当X表示温度时,Y表示平衡常数K |
| B.当X表示温度时,Y表示CO的转化率 |
| C.当X表示N2的物质的量时,Y表示NO的转化率 |
| D.当X表示NO的物质的量时,Y表示平衡常数K |
D
解析

练习册系列答案
相关题目
在其它条件不变时,10℃时以某物质表示的反应速率为3 mol?(L· s )-1,已知温度每升高10℃反应速率是原来的2倍,则温度为50℃时,该反应的速率为
| A.48 mol?(L· s )-1 | B.36 mol?(L· s )-1 |
| C.24 mol?(L· s )-1 | D.12 mol?(L· s )-1 |
2SO2+O2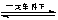 2SO3是接触法制硫酸工艺中的重要反应,下列关于该反应的说法中错误的是
2SO3是接触法制硫酸工艺中的重要反应,下列关于该反应的说法中错误的是
| A.增加SO2的浓度能加快该反应的速率 |
| B.通常使用铁作催化剂 |
| C.降低体系温度会减慢该反应的速率 |
| D.使用催化剂能改变该反应的速率 |
下列反应达到化学平衡后,加压或升温都能使化学平衡向逆反应方向移动的是
A.SO2(g)+NO2(g)  SO3(g)+NO(g) ΔH<0 SO3(g)+NO(g) ΔH<0 |
B.C(s)+CO2(g)  2CO(g)ΔH>0 2CO(g)ΔH>0 |
C.4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH<0 4NO(g)+6H2O(g)ΔH<0 |
D.H2S(g)  H2(g)+S(s)ΔH>0 H2(g)+S(s)ΔH>0 |
下列有关说法正确的是( )。
| A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0 |
| B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反 |
C.对于N2(g)+3H2(g) 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 |
| D.100 ℃时水的离子积常数KW为5.5×10-13,说明水的电离是放热反应 |
一定条件下,在体积为10 L的密闭容器中,2 mol X和2 mol Y 进行反应:2X(g)+Y(g) Z(g),经2 min达到平衡,生成0.6 mol Z,下列说法正确的是( )
Z(g),经2 min达到平衡,生成0.6 mol Z,下列说法正确的是( )
| A.以X浓度变化表示的反应速率为0.001 mol·L-1·s-1 |
| B.将容器体积变为20 L,Z的平衡浓度为原来的1/2 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的ΔH>0 |
已知反应4NH3+5O2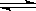 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是( )
A.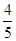 v(NH3)=v(O2) v(NH3)=v(O2) | B.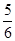 v(O2)=v(H2O) v(O2)=v(H2O) | C.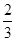 v(NH3)=v(H2O) v(NH3)=v(H2O) | D.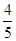 v(O2)=v(NO) v(O2)=v(NO) |
在5 mL 0.1 mol·L-1 KI溶液中滴加0.1 mol·L-1 FeCl3溶液5~6滴后,再进行下列实验,其中可证明FeCl3与KI的反应是可逆反应的实验(含现象)是( )
| A.滴加AgNO3溶液,有黄色沉淀产生 |
| B.加入CCl4振荡,下层液体为浅紫色 |
| C.加入CCl4振荡,下层液体为浅紫色;取上层清液,滴加AgNO3溶液,有白色沉淀产生 |
| D.加入CCl4振荡,下层液体为浅紫色;取上层清液,滴加KSCN溶液,溶液显红色 |
在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3—(aq)。测得不同温度下该反应的平衡常数K如表所示:
I3—(aq)。测得不同温度下该反应的平衡常数K如表所示:
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1 100 | 841 | 689 | 533 | 409 |
下列说法正确的是( )。
A.反应I2(aq)+I-(aq)
 I3—(aq)的ΔH>0
I3—(aq)的ΔH>0B.其他条件不变,升高温度,溶液中c(I3—)减小
C.该反应的平衡常数表达式为K=
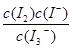
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689