题目内容
据报道,某些建筑材料会产生放射性同位素氡 ,从而对人体产生危害。该同位素原子的中子数和质子数之差为
,从而对人体产生危害。该同位素原子的中子数和质子数之差为
| A.136 | B.50 | C.86 | D.222 |
B
解析试题分析:质子数为86,质子数和中子数之和为222,中子数为136,中子数和质子数之差为50;故选B。
考点:原子构成微粒间的数量关系

练习册系列答案
相关题目
在多电子原子中,轨道能量是由以下哪些因素决定
③空间伸展方向④自旋状态
| A.①② | B.①④ | C.②③ | D.③④ |
下列实验操作及现象与实验结论都正确且有因果关系的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 分别点燃乙烯和乙炔,乙炔产生的黑烟更浓 | 乙炔的含碳量高于乙烯 |
| B | 在滴有酚酞的Na2CO3溶液中加入BaCl2溶液后红色褪去 | BaCl2溶液呈酸性 |
| C | 分别取绿豆大的钾和钠,用滤纸吸干表面的煤油,投入盛水的烧杯中,钾反应更剧烈 | 钾的金属性比钠强 |
| D | 测定相同浓度的盐酸和磷酸溶液的pH:盐酸的pH较小 | 氯的非金属性比磷强 |
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,
| | R | | |
| T | Q | | W |
其中T所处的周期序数与族序数相等。下列判断不正确的是
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐溶液一定显酸性
下列说法正确的是
| A.某粒子的电子数等于质子数,则该粒子可能是一种分子或一种离子 |
| B.构成单质的分子中一定含有共价键 |
| C.溶液和胶体的本质区别是有无丁达尔效应 |
| D.化学变化不产生新元素,产生新元素的变化不是化学变化 |
元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列得到如图所示的“蜗牛”元素周期表。图中每个“·”代表一种元素(图中字母不表示元素符号)。下列说法正确的是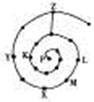
| A.L、M、X三元素位于同一族 |
| B.K、Z两元素的氢化物的水溶液都显酸性 |
| C.Y元素对应的氢化物比K元素对应的氢化物沸点低 |
| D.K、L、X、Z四种元素离子半径大小顺序是Z->L+>X3+>K3- |
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期主族元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层都达到8电子稳定结构 |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
最近医学界通过放射性14C来标记C60的羧酸衍生物在特定条件下通过断裂DNA来杀死细胞,从而抑制艾滋病(AIDS),有关14C的叙述正确的是 ( )
| A.与C60中普通碳原子的化学性质不同 | B.与12C互为同位素 |
| C.与14N含的中子数相同 | D.是C60的同素异形体 |
四种短周期元素W、R、P、Q的原子序数依次增大,W的一种核素没有中子,R、Q同主族,R元素原子的最外层电子数是内层电子数的3倍,P元素与R元素形成的常见化合物中既含离子键又含非极性共价键。下列说法不正确的是
| A.沸点:W2R>W2Q | B.P与R形成化合物中,阴、阳离子个数比一定为1:2 |
| C.原子半径:W<R<Q<P | D.Q元素形成的酸一定是强酸 |