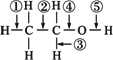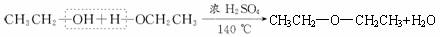题目内容
乙醇分子中有各种化学键。如: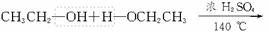
关于乙醇在下列各种反应中,对化学键断裂的说法中,正确的是( )
A.乙醇跟钠反应时,化学键④断裂
B.乙醇在Cu作催化剂条件下生成乙醛的反应中,化学键①⑤断裂
C.乙醇跟浓H2SO4共热到
D.乙醇跟浓H2SO4共热到
解析:有机物的结构决定化学性质,而化学性质又反映其结构。这表明结构和性质有密切联系。为此,要想深入理解化学反应的历程,就应知道其结构及在反应中断键的方式。
A项是乙醇跟钠发生的置换反应,是键⑤断裂,不是键④断裂,是错的。
B项是乙醇被氧化成乙醛的反应,是键③⑤断裂,不是键①⑤断裂,是错的。
C项是乙醇发生消去反应,是键①④发生断裂,是正确的。
D项是乙醇分子间的脱水,生成醚的反应,是1个分子的键⑤和另1个分子的键④断裂,是正确的。
![]() CH3CH2—O—CH2CH3+H2O
CH3CH2—O—CH2CH3+H2O
答案:CD

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案|
乙醇分子中有各种化学键.如:
关于乙醇在下列各种反应中,对化学键断裂的说法中,正确的是 | |
A. |
乙醇跟钠反应时,化学键④断裂 |
B. |
乙醇在Cu作催化剂条件下生成乙醛的反应中,化学键①⑤断裂 |
C. |
HRO3 |
D. |
NaR |
(21分)(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=__________(填表达式,不用化简);若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”);若将稀硫酸换成浓硫酸来做该实验,测得的△H_______(填“偏大”、“偏小”或“相同”)。
(2)某高能化学物质N2H2内,氮元素的杂化类型为____,电子式为____,一个分子中有σ键 个 ,π 键 个。
(3).在密闭容器中进行可逆反应: CO(g)+NO2(g) CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通人CO2气体,平衡 移动,反应混合物的颜色 。若通人N2气体,平衡 移动,反应混合物的颜色 。③加入催化剂,平衡 移动。
(4)下表是几种常用燃料(1 mol)完全燃烧时放出的热量:
| 物质 | 炭粉(C) | 一氧化碳(CO) | 氢气(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1 367 |
②写出管道煤气中的一氧化碳燃烧热的热化学方程式_______________________
③充分燃烧1 mol表中各种燃料,排放出二氧化碳的量最多的是________。
④矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有________等。
 填空题
填空题