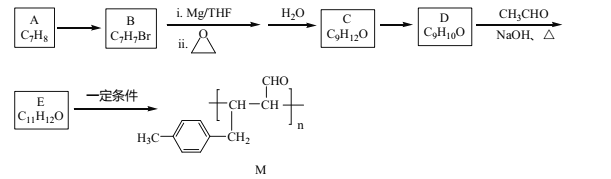
题目内容
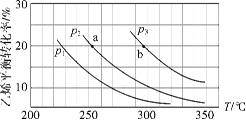
【题目】T℃时,三种盐的沉淀溶解平衡曲线如图所示,已知pM为阳离子浓度的负对数,pR为阴离子浓度的负对数,下列说法正确的是

A.Y点:![]() ,Z点:
,Z点:![]()
B.溶度积:Ksp(MnCO3)>Ksp(CaCO3)>Ksp(CaSO4)
C.X点对应的CaCO3溶液为不饱和溶液,可以继续溶解CaCO3
D.T℃时,![]() 的平衡常数K的数量级为103
的平衡常数K的数量级为103
【答案】D
【解析】
pM为阳离子浓度的负对数,pR为阴离子浓度的负对数,说明数值越大,对应的离子浓度越小;根据O、P、Q三点可求出MnCO3、CaCO3、CaSO4的Ksp值,即可比较溶解度大小;若Qc值大于Ksp,则有沉淀生成;据此分析。
A.Y点pM大于3,pR小于3,则阴离子浓度大于阳离子浓度,即c(SO42-)>c(Ca2+);同理,Z点c(Mn2+)>c(CO32-),A错误;
B.根据O、P、Q三点求MnCO3、CaCO3、CaSO4的Ksp值,Ksp(MnCO3)= c(Mn2+)c(CO32-)=10-5.3×10-5.3=10-10.6;同理可得,Ksp(CaCO3)=10-8.6;Ksp(CaSO4)=10-5,故溶度积:Ksp(MnCO3)<Ksp(CaCO3)<Ksp(CaSO4),B错误;
C.X点的Qc值大于Ksp(CaCO3),有沉淀生成,不能再溶解CaCO3,C错误;
D.T℃时,![]() 的平衡常数K=
的平衡常数K=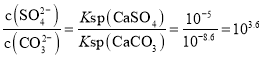 ,数量级为103,D正确;
,数量级为103,D正确;
答案选D。

【题目】某温度下,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g) ![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是( )
A.反应在前50 s的平均反应速率为v(PCl3)=0.006 4 mol/(L·s)
B.相同温度下,起始时向该容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
C.相同温度下,起始时向该容器中充入2.0 mol PCl5、0.4 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆)
D.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则反应的ΔH<0
【题目】氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.2000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1) 配平离子方程式:______MnO4-+HSO3-+H+=Mn2++SO42-+H2O。
(2)用KMnO4进行滴定时,KMnO4溶液应装在_______________中,判断滴定终点的现象是_______。
(3)下列操作会导致测定结果偏高的是_________。
A. 盛装未知浓液的锥形瓶用蒸馏水洗过,未用待测液润洗
B. 未用标准浓度的酸性KMnO4溶液润洗滴定管
C. 观察读数时,滴定前仰视,滴定后俯视
D. 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(4) 根据下表测定的实验数据,计算KMnO4溶液体积的平均值为___mL;NaHSO3溶液的物质的量浓度为___mol/L(数据精确到0.1)。
试验编号 | 待测NaHSO3溶液的体积/ mL | KMnO4溶液体积/ mL |
1 | 20.00 | 15.98 |
2 | 20.00 | 17.00 |
3 | 20.00 | 16.02 |