题目内容
【题目】图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分. 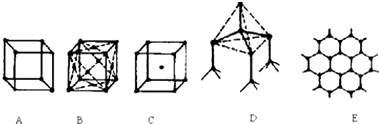
(1)其中代表金刚石的是(填编号字母,下同) , 金刚石中每个碳原子与个碳原子最接近且距离相等.金刚石属于晶体;
(2)其中代表石墨是 , 其中每个正六边形占有的碳原子数平均为个;
(3)代表干冰的是 , 它属于晶体,每个CO2分子与个CO2分子紧邻;
(4)上述三种物质熔点由高到低的排列顺序为 .
(5)含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数增大而增大,即(HO)mROn中,n值越大,酸性越 .
【答案】
(1)D;4;原子
(2)E;2
(3)B;分子;12
(4)石墨>金刚石>干冰
(5)强
【解析】解:(1.)在金刚石晶胞中,每个碳可与周围四个碳原子形成共价键,将这四个碳原子连结起来后可以形成正四面体,体心有一个碳原子,所以图D为金刚石,每个碳原子与四个碳原子最近且距离相等,金刚石属于原子晶体,所以答案是:D,4;原子;
(2.)石墨是层状结构,在层与层之间以范德华力相互作用,有分子晶体的特点,在层内碳与碳以共价键相互作用,形成六边形,有原子晶体的特点,所以图E为石墨的结构,为混合晶体,其中每个正六边形占有的碳原子数平均为6× ![]() =2,所以答案是:E;2;
=2,所以答案是:E;2;
(3.)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上,所以图B为干冰晶体,所以答案是:B;分子;12;
(4.)石墨是层状结构,C原子sp2杂化,与3个C原子形成σ键,未杂化的1个p轨道形成大π键,金刚石,是空间网状结构,C原子sp3杂化,与4个C原子成键,sp2杂化中,s轨道的成分比sp3杂化更多,所以形成的共价键更短,更牢固,即石墨的层内共价键键长比金刚石的键长短,作用力更大,破坏化学键需要更大能量,所以石墨的熔点比金刚石高,干冰是分子晶体,熔点最低,所以答案是:石墨>金刚石>干冰;
(5.)含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数增大而增大,即(HO)mROn中,n值越大,酸性越强,所以答案是:强.

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的(填仪器名称)的初始读数.
如果液面位置如右图所示,则此时的读数为mL.![]()
(4)滴定.当时,停止滴定,
并记录NaOH溶液的终读数.重复滴定3次.
(5)Ⅱ.实验记录
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
经计算,市售白醋总酸量=g/100mL.
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时距离摇动,有少量液体溅出.