题目内容
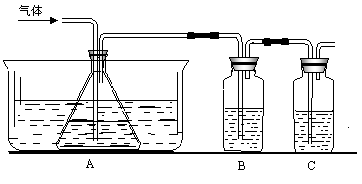
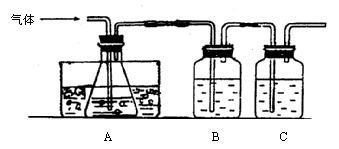
已知FeSO4在高温下分解生成Fe2O3、SO3和SO2.某研究性学习小组先用如图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量.
请回答下列问题:
(1)实验时,A瓶内盛水,水中滴有数滴________溶液,B瓶内盛品红试液,C瓶内盛NaOH溶液,NaOH溶液的作用是________.
(2)A瓶内所盛试剂的作用是________,A瓶要用冰水冷却的原因是________.
(3)检验后,用A瓶内的混合物测定FeSO4已分解的质量,其实验操作的第一步是(简述操作步骤)________.
(4)测定过程中,在过滤器上将沉淀洗净后,将沉淀灼烧并冷却至室温,称量其质量为a1 g,再次灼烧并冷却至室温称量其质量为a2 g,且a2<a1,接下来的操作应当是________.
(5)已经分解的FeSO4的质量是________(填计算式).
解析:
|
(1)BaCl2,吸收SO2 (2)检验并吸收SO3,SO3与H2O反应放出大量的热 (3)向A瓶中逐滴滴加BaCl2溶液,直至不再产生新的沉淀. (4)继续灼烧、冷却、称重,直至连续两次称量的质量不变. (5) |

 习题精选系列答案
习题精选系列答案
| |||||||||||||||||||||||
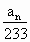 ×152×2g(ang是最后一次称量的质量)
×152×2g(ang是最后一次称量的质量)