��Ŀ����
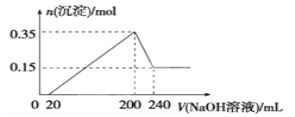
����Ŀ����һ��������þ�������Ͷ��200 mLϡ�����У�����ȫ���ܽ����������Һ����μ��� NaOH ��Һ�����ɳ��������ʵ��������� NaOH ��Һ����ı仯��ϵ��ͼ��ʾ��������˵������ȷ���ǣ� ��
A. þ������������Ϊ9 g
B. ���ɵ������ڱ�״���µ����Ϊ11.2 L
C. ���20 mL NaOH��Һ�����к���������
D. ����������Һ�����ʵ���Ũ��Ϊ5 mol��L-1
���𰸡�B
����������ͼ���֪���ӿ�ʼ������NaOH��Һ20mL��û�г������ɣ�˵��ԭ��Һ�������ܽ�Mg��Al��������ʣ�࣬��ʱ�����ķ�ӦΪ��H2SO4+2NaOH=Na2SO4+2H2O����V��NaOH��Һ��=200mLʱ�����������ʱΪMg��OH��2��Al��OH��3���������ʵ���֮��Ϊ0.35mol����Һ������ΪNa2SO4��������Ԫ���غ��֪��ʱn��Na2SO4������200mL����������Һ�к��е�n��NaOH����1/2������200mL��240mL��NaOH�ܽ�Al��OH��3��NaOH+Al��OH��3=NaAlO2+2H2O����V��NaOH��Һ��=240mLʱ���������ټ��٣���ʱȫ��ΪMg��OH��2�����ʵ���Ϊ0.15mol����Al��OH��3Ϊ0.35mol-0.15mol=0.2mol�����ڴ�200mL��240mL��NaOH�ܽ�Al��OH��3��NaOH+Al��OH��3=NaAlO2+2H2O�����Ըý�����n��NaOH��=n[Al��OH��3]=0.2mol���������Ƶ�Ũ��Ϊ0.2mol��(0.24L0.20L)=5mol/L��A����Ԫ���غ��֪n��Al��=n[Al��OH��3]=0.2mol��n��Mg��=n[Mg��OH��2]=0.15mol����þ������������Ϊ0.2mol��27g/mol+0.15mol��24g/mol=9g��A��ȷ��B����A�п�֪n��Al��=0.2mol��n��Mg��=0.15mol�����ݵ���ת���غ��֪2n��H2��=3n��Al��+2n��Mg��=3��0.2mol+2��0.15mol=0.9mol������n��H2��=0.45mol���������Ϊ0.45mol��22.4mol/L=10.08L��B����C����ͼ���֪���ӿ�ʼ������NaOH��Һ20mL��û�г������ɣ�˵��ԭ��Һ�������ܽ�Mg��Al��������ʣ�࣬��ʱ�����ķ�ӦΪH2SO4+2NaOH=Na2SO4+2H2O��C��ȷ��D���������Ϸ�����֪����������Һ�����ʵ���Ũ��Ϊ5 mol��L-1��D��ȷ����ѡB��

 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�