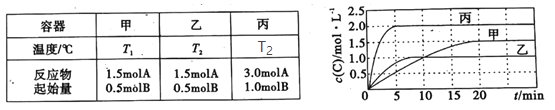
题目内容
【题目】草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性。向10mL 0.01mol·L-1的H2C2O4溶液滴加0.01mol·L-1KOH溶液V(mL),回答下列问题。
(1)当V<10mL时,反应的离子方程式为___。
(2)当V=10mL时,溶液中HC2O4-、C2O42-、H2C2O4、H+的浓度从大到小的顺序为___。
(3)当V=a mL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+(HC2O4-);当V=b mL时,溶液中离子浓度有如下关系:c(K+)= c(C2O42-)+c(HC2O4-)+c(H2C2O4);则a___b(填“<”“=”或“>”)。
(4)当V=20mL时,再滴入NaOH溶液,则溶液中![]() 的值将___(填“变大”“变小”或“不变”)。
的值将___(填“变大”“变小”或“不变”)。
【答案】H2C2O4+OH-=HC2O4-+H2O c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4) > 变小
【解析】
①草酸是二元酸,其和KOH的反应,是分步的:KOH+H2C2O4=KHC2O4+H2O,KOH+KHC2O4=K2C2O4+H2O;当第一步反应中,KOH过量时,剩余的KOH才会进行第二步反应;②KHC2O4溶液呈酸性,说明HC2O4-的电离程度大于水解程度;据此答题。
(1)当V<10mL时,n(KOH)<0.01L×0.01mol·L-1=n(H2C2O4),则发生反应KOH+H2C2O4=KHC2O4+H2O,离子方程式为H2C2O4+OH-=HC2O4-+H2O;
(2)当V=10mL时,溶液中的溶质为KHC2O4,由于KHC2O4溶液呈酸性,即HC2O4-的电离程度大于水解程度,所以KHC2O4溶液中,c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4);
(3)溶液中,电荷守恒式为c(H+)+c(K+)=2c(C2O42-)+(HC2O4-)+c(OH-),若c(K+)=2c(C2O42-)+(HC2O4-),则c(H+)= c(OH-),此时V=a mL,则a>10;在KHC2O4溶液中有c(K+)= c(C2O42-)+c(HC2O4-)+c(H2C2O4),即V=b mL=10mL;所以a>b;
(4)V=20mL时,溶液中的溶质只有K2C2O4,溶液中存在水解平衡,主要为:C2O4-+H2O![]() HC2O4-+OH-,再滴入NaOH溶液,该水解平衡向左移动,即n(C2O42-)增大,n(K+)不变,所以
HC2O4-+OH-,再滴入NaOH溶液,该水解平衡向左移动,即n(C2O42-)增大,n(K+)不变,所以![]() 减小。
减小。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】软锰矿的主要成分MnO2,还含有Fe2O3、Al2O3、SiO2等,用软锰矿浆吸收工业废气中的二氧化硫,制备高锰酸钾的流程如图所示:

已知:滤液A中的金属阳离子主要是Mn2+还含有少量的Fe2+、Al3+等,几种离子开始沉淀和完全沉淀时的pH如右表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
根据上述流程,回答下列问题:
(1)写出软锰矿通入二氧化硫发生的主要反应的化学方程式__。
(2)滤渣A的成分是__,其中的化学键类型是___。
(3)步骤②中加入MnO2的作用__。
(4)有同学认为可以用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2]替代石灰乳,你是否同意此观点___?简述理由___。
(5)滤液B中加入KMnO4时发生反应的离子方程式是__。
(6)第⑦步用镍片(镍不参与反应)和铁板作电极,电解K2MnO4溶液可制备KMnO4。有关说法正确的是__(填字母)

A.a与电源的负极相连
B.离子交换膜为阳离子交换膜
C.阳极的电极反应为MnO42--e-=MnO4-
D.阴极的电解产物为KOH