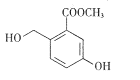
题目内容
【题目】常温下,用0.1000mol·L-1的盐酸滴 0.1000mol·L-1Na2CO3溶液25.00mL。用pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是
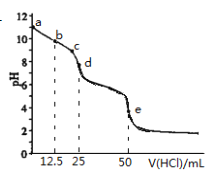
A. c→d点发生的主要离子反应:HCO3-+H+=H2O+CO2
B. 在b点时,c(CO32-)>c(HCO3-)>c(OH-)
C. 在d点时, c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D. 在e点时, c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
【答案】D
【解析】A.a点为碳酸钠溶液,b点加入12.5mL盐酸时有1/2的Na2CO3转化成NaHCO3;d点加入25mL盐酸时二者恰好反应生成碳酸氢钠;e点加入50mL盐酸,反应后溶质为NaCl,故c→d发生的主要离子反应:CO32-+H+=HCO3-,A错误;B.b点时,有1/2的Na2CO3转化成NaHCO3,由于CO32-的水解程度大于HCO3-的水解程度,故c(HCO3-)>c(CO32-)>c(OH-),B错误;C.d点加入25mL盐酸时二者恰好反应生成碳酸氢钠,根据碳酸氢钠溶液中的质子守恒可得:c(OH-)=c(H+)+c(H2CO3)-c(CO32-),C错误;D.在e点时,根据电荷守恒可得:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),由于c(Na+)=c(Cl-),则c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),D正确;答案选D。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g)![]() 2CO2(g) ΔH=-akJ/mol
2CO2(g) ΔH=-akJ/mol
②N2(g)+O2(g)![]() 2NO(g) ΔH=+bkJ/mol
2NO(g) ΔH=+bkJ/mol
③2NO(g)+O2(g)![]() 2NO2(g) ΔH=-ckJ/mol
2NO2(g) ΔH=-ckJ/mol
回答下列问题:
(1)CO的燃烧热为_________。
(2)CO将NO2还原为单质的热化学方程式为_________。
(3)为了模拟反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)=_________,此温度下,该反应的平衡常数K=_________。
②能说明上述反应达到平衡状态的是________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。
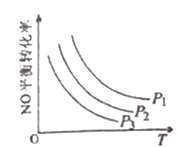
则NO的平衡转化率随温度升高而减小的原因是______________,图中压强(P1、P