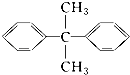
题目内容
【题目】I.化工工业中常用乙苯脱氢的方法制备苯乙烯.
已知某温度下:
反应①:CO2(g)+H2(g)→CO(g)+H2O(g),△H=+41.2kJ/mol;
反应②: ![]() (g)→
(g)→ ![]() (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol;
①②的化学反应平衡常数分别为K1、K2 ,
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式
该反应的化学平衡常数K=(用K1、K2表示)
(2)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2;请在图中画出t1之后的正逆反应曲线,并作出标注. 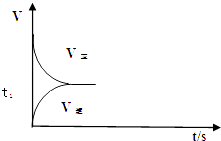
(3)Ⅱ.一定的条件下,合成氨反应为:N2(g)+3H2(g)2NH3(g).图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响. 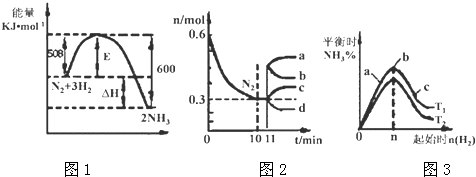
升高温度,该反应的平衡常数(填“增大”或“减小”或“不变”).
(4)由图2信息,计算10min内该反应的平均速率v(H2)= , 从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为(填“a”或“b”或“c”或“d”)
(5)图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是点,温度T1T2(填“>”或“=”或“<”)
【答案】
(1)CO2(g)+ 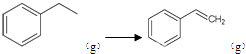 +CO(g)+H2O(g)△H=+158.8 kJ/mol;K1?K2
+CO(g)+H2O(g)△H=+158.8 kJ/mol;K1?K2
(2)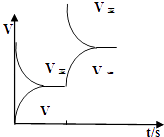
(3)减小
(4)0.045mol/(L?min);d
(5)c;<
【解析】解:(1.)已知反应①:CO2(g)+H2(g)→CO(g)+H2O(g)△H=+41.2kJ/mol;
反应②: ![]() (g)→
(g)→ ![]() (g)+H2(g)△H=+117.6kJ/mol;根据盖斯定律:①+②,得 CO2(g)+
(g)+H2(g)△H=+117.6kJ/mol;根据盖斯定律:①+②,得 CO2(g)+ 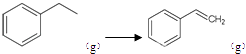 +CO(g)+H2O(g)△H=+41.2+117.6=+158.8kJ/mol,反应①与②相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K1K2 , 所以答案是:CO2(g)+
+CO(g)+H2O(g)△H=+41.2+117.6=+158.8kJ/mol,反应①与②相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K1K2 , 所以答案是:CO2(g)+ 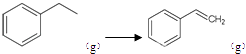 +CO(g)+H2O(g)△H=+158.8 kJ/mol;K1K2;
+CO(g)+H2O(g)△H=+158.8 kJ/mol;K1K2;
(2.)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2 , 则正反应速率瞬间增大,逆反应速率逐渐增大,其t1之后的正逆反应曲线为: 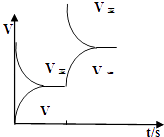 ,
,
所以答案是: 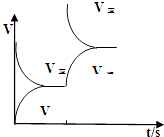 ;
;
(3.)Ⅱ.N2(g)+3H2(g)2NH3(g),反应的焓变△H=﹣(600KJ/mol﹣508KJ/mol)=﹣92KJ/mol;图2分析可知反应进行的氮气的起始量为0.6mol,反应过程中消耗氮气物质的量为0.3mol,依据热化学方程式计算得到反应过程中放热=92KJ/mol×0.3mol=27.6KJ;图象1分析可知反应是放热反应,反应物能量高于生成物能量,温度升高平衡逆向进行,平衡常数减小,所以答案是:减小;
(4.)图象分析2L的密闭容器中,V(N2)= ![]() V(H2)=
V(H2)= ![]() =0.015mol/Lmin,V(H2)=0.045mol/Lmin;从11min起其它条件不变,压缩容器的体积为1L,压强增大,平衡正向进行,瞬间氮气物质的量不变,随平衡正向进行,氮气物质的量减小,则n(N2)的变化曲线d符合;所以答案是:0.045mol/Lmin;d;
=0.015mol/Lmin,V(H2)=0.045mol/Lmin;从11min起其它条件不变,压缩容器的体积为1L,压强增大,平衡正向进行,瞬间氮气物质的量不变,随平衡正向进行,氮气物质的量减小,则n(N2)的变化曲线d符合;所以答案是:0.045mol/Lmin;d;
(5.)图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,故a、b、c都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大,故a、b、c三点中,c的氮气的转化率最高;由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2 , 温度越高化学平衡越低,故K1>K2;所以答案是:c;<.
【考点精析】掌握化学平衡状态本质及特征和化学平衡的计算是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.