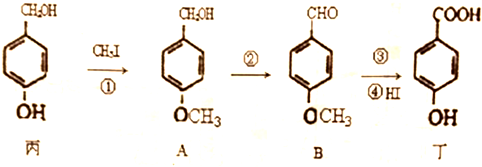
题目内容
10.下面关于烃的结构叙述不正确的是( )| A. | 甲烷分子是正方形分子 | |
| B. | 乙烯是平面形结构 | |
| C. | 乙炔分子中的4个原子在同一条直线上 | |
| D. | 丙炔的三个碳原子在同一直线上 |
分析 A.甲烷是正四面体结构;
B.乙烯是平面结构;
C.乙炔是直线型结构;
D.乙炔是直线型结构,丙炔分子中甲基上的碳原子处于乙炔中氢的位置.
解答 解:A.甲烷是正四面体结构,不是平面结构,故A错误;
B.乙烯是平面结构,所以原子在同一平面内,故B正确;
C.乙炔是直线型结构,4个原子在同一条直线上,故C正确;
D.乙炔是直线型结构,丙炔分子中甲基上的碳原子处于乙炔中氢的位置,所以分子中三个碳原子位于同一直线上,故D正确.
故选A.
点评 本题主要考查有机化合物的结构特点,难度不大,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构.

练习册系列答案
相关题目
8.下列有关说法正确的是( )
| A. | 气体的摩尔体积即标准状况下单位物质的量气体的体积 | |
| B. | 温度压强一定的情况下,气体的体积决定于气体的物质的量多少和分子本身的大小 | |
| C. | 配制物质的量浓度的溶液,定容时俯视,配得溶液浓度偏大 | |
| D. | 电解18g水,两极生成的气体体积比约为2:1,质量比2:16 |
1.如表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y是地壳中含量最高的元素.
请回答下列问题:
(1)X元素在周期表中的位置是第二周期VA族,Z元素的名称是硫.
(2)W、X、Y三种元素中,原子半径最大的是C;其氢化物中最稳定的是H2O,既含有极性共价键又含有非极性共价键的是H2O2 等.(任写一种,均写化学式)
(3)由W、Y和Z三种元素组成的化合物WYZ中,所有原子的最外层都满足8电子结构,写出该化合物的电子式: .
.
请回答下列问题:
| W | X | Y |
| Z |
(2)W、X、Y三种元素中,原子半径最大的是C;其氢化物中最稳定的是H2O,既含有极性共价键又含有非极性共价键的是H2O2 等.(任写一种,均写化学式)
(3)由W、Y和Z三种元素组成的化合物WYZ中,所有原子的最外层都满足8电子结构,写出该化合物的电子式:
 .
.
15.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1 mol NH4+ 所含质子数为10NA | |
| B. | 10克氖气所含原子数约为6.02×1023 | |
| C. | 标准状况下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下,32 g O2和O3的混合气体所含氧原子数为2NA |
2.下列关于乙醇的说法中不正确的是( )
| A. | 可以使酸性重铬酸钾溶液褪色 | B. | 可由乙烯通过加成反应获得 | ||
| C. | 与二甲醚互为同分异构体 | D. | 通过取代反应可制取乙酸乙酯 |
19.一定温度下的可逆反应:A(g)+2B(g)?3C(g),下列叙述中能说明反应已达到平衡的是( )
| A. | 容器内的压强不再变化 | |
| B. | 单位时间内消耗amolA,同时生成3amolC | |
| C. | C生成的速率与C分解的速率相等 | |
| D. | 混合气体的物质的量不再变化 |
20.将2.0mol SO2气体和2.0mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)?2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
| A. | 1.6 mol SO2+0.3 mol O2+0.4 mol SO3 | |
| B. | 3.0 mol SO2+0.5 mol O2+1.0 mol SO3 | |
| C. | 3.0 mol SO2+1.0 mol O2+1.0 mol SO3 | |
| D. | 4.0 mol SO2+1.0 mol O2+0.1 mol SO3 |
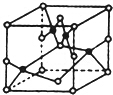 A、B、C、D、E、F六种元素的原子序数依次增大.已知:F的原子序数为29,其余均为短周 期主族元素;E原子价电子(外围电子)排布式为 msnmpn-1;D原子的最外层电子数为偶数;A、C原子 的P轨道上都有两个未成对电子.请回答下列问题:
A、B、C、D、E、F六种元素的原子序数依次增大.已知:F的原子序数为29,其余均为短周 期主族元素;E原子价电子(外围电子)排布式为 msnmpn-1;D原子的最外层电子数为偶数;A、C原子 的P轨道上都有两个未成对电子.请回答下列问题: