题目内容
“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的副作用。下面化学反应不符合绿色化学概念的是
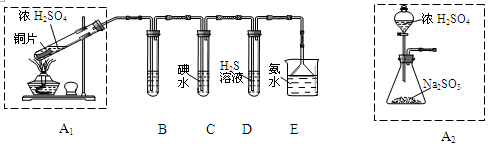
| A.消除硫酸厂尾气排放:SO2+2NH3 = (NH4)2SO3 |
| B.消除制硝酸工业尾气排放:NO2+NO+2NaOH =2NaNO2+H2O |
| C.制CuSO4:Cu+2H2SO4(浓) = CuSO4+SO2↑+2H2O |
| D.制CuSO4:2Cu+O2= 2CuO CuO+H2SO4(稀) = CuSO4+H2O |
C
试题分析:A、用氨水吸收含二氧化硫的尾气,减少对空气的污染,正确;B、将氮的氧化物气体转化为固态亚硝酸盐,减少对空气的污染,正确;C、用铜与浓硫酸共热制取硫酸铜,产生二氧化硫气体,对环境造成污染,错误;D、铜与氧气反应生成氧化铜,氧化铜再与稀硫酸反应制取硫酸铜,不产生二氧化硫,对环境无污染,且耗用硫酸较少,正确,答案选C。

练习册系列答案
相关题目