题目内容
10.下列叙述正确的是( )| A. | Na2O与Na2O2中阳离子和阴离子的个数比分别为2:1和1:1 | |
| B. | Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 | |
| C. | Na2CO3溶液能与Ca(OH)2反应产生白色沉淀,而NaHCO3溶液不能 | |
| D. | Na2O2可作供氧剂,而Na2O不行 |
分析 A、Na2O2的电子式为 ,阴、阳离子的个数比为1:2;
,阴、阳离子的个数比为1:2;
B、Na2CO3溶液和CaCl2溶液反应,NaHCO3溶液和CaCl2溶液不反应;
C、Na2CO3溶液能与Ca(OH)2反应产生白色沉淀,NaHCO3溶液也能;
D、Na2O2可作氧气的来源,但是氧化钠不行.
解答 解:A、Na2O2的电子式为 ,阳离子和阴离子的个数比分别为2:1,Na2O阳离子和阴离子的个数比分别为2:1,故A错误;
,阳离子和阴离子的个数比分别为2:1,Na2O阳离子和阴离子的个数比分别为2:1,故A错误;
B、Na2CO3溶液和CaCl2溶液反应产生白色沉淀,NaHCO3溶液和CaCl2溶液不反应,故B错误;
C、Na2CO3溶液能与Ca(OH)2反应产生白色沉淀,NaHCO3溶液也能与Ca(OH)2反应产生白色沉淀,故C错误;
D、Na2O2可和水以及二氧化碳反应产生氧气,作氧气的来源,但是氧化钠不行,故D正确.
故选D.
点评 本题考查学生氧化钠、过氧化钠性质的差异,注意过氧化钠和氧化钠中微粒的区别是关键,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g)△H<0.现将1mol A和2mol B加入甲容器中,将4molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )
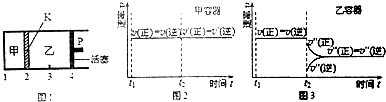

| A. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数分别为增大和减小 | |
| B. | 保持温度和活塞位置不变,在甲中再加入1mol A和2mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率 变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
1.某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了一系列实验,实验结果记录如下
试根据表中的实验现象回答下列问题:
(1)实验1、2中Al所做的电极(正极或负极)不相同(填“相同”或“不同”).
(2)对实验3完成下列填空
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
(3)实验4中铝作负极,理由是Al失去电子,写出铝电极的电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子作负极,反之作正极.
| 编号 | 电极材料 | 电解质溶液 | 电液计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所做的电极(正极或负极)不相同(填“相同”或“不同”).
(2)对实验3完成下列填空
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
(3)实验4中铝作负极,理由是Al失去电子,写出铝电极的电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子作负极,反之作正极.
10.在氧化钕(Nd2O3)等稀土催化剂的作用下可发生反应:4CO+2NO2═N2+4CO2,若该反应的反应速率分别用v(CO)、v(NO2)、v(N2)、v(CO2)表示,则下列关系正确的是( )
| A. | $\frac{1}{2}$v(CO)=v(NO2) | B. | $\frac{1}{2}$v(NO2)=v(CO2) | C. | $\frac{1}{4}$v(N2)=v(CO2) | D. | $\frac{1}{4}$v(N2)=v(CO) |
 在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间 t(min)的变化曲线如图所示,回答下列问题:
在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间 t(min)的变化曲线如图所示,回答下列问题:
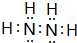 ;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为开始生成蓝色沉淀,后蓝色沉淀溶解,得到深蓝色的透明溶液.
;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为开始生成蓝色沉淀,后蓝色沉淀溶解,得到深蓝色的透明溶液.