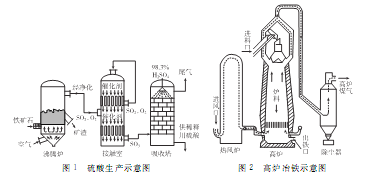
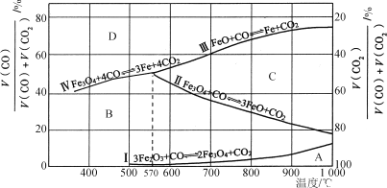
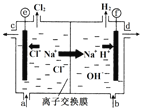
题目内容
【题目】200 mL硝酸与一定量铝铁合金反应生成 3.36 L NO(标况),向反应后的溶液中加入150 mL 3 mol·L1的NaOH溶液,使铝铁元素恰好全部转化为沉淀,则原硝酸的浓度是
A.3 mol·L1 B.2.25 mol·L1 C.1. 5 mol·L1 D.无法计算
【答案】A
【解析】硝酸和金属反应生成硝酸盐和NO,硝酸盐和NaOH完全反应生成氢氧化物沉淀,硝酸根离子和氢氧根离子都带一个单位负电荷,则生成氢氧化物、硝酸盐消耗的n(OH-)=n(![]() )=3 mol/L×0.15 L=0.45 mol,原来溶液中n(HNO3)=n(
)=3 mol/L×0.15 L=0.45 mol,原来溶液中n(HNO3)=n(![]() )+n(NO)=0.45 mol+3.36 L/22.4 L/mol=0.6 mol,则原来硝酸浓度=0.6 mol/0.2 L=3 mol/L,答案选A。
)+n(NO)=0.45 mol+3.36 L/22.4 L/mol=0.6 mol,则原来硝酸浓度=0.6 mol/0.2 L=3 mol/L,答案选A。

练习册系列答案
相关题目