题目内容
【题目】常温下,向lLpH =10的KOH溶液中持续通入CO2。溶液中水电离出的c(OH- )与通入CO2的体积(V)关系如图所示。下列叙述不正确的是( )
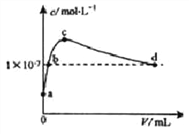
A. b点溶液呈中性
B. d 点溶液中:c(K+) = 2c(CO32-) + c(HCO3-)
C. c点溶液中:2c(H2CO3)+c(H+) + c(HCO3-) = c(OH-)
D. a点溶液中:水电离出的c(H+)= 1×l0-10mol·L-1
【答案】A
【解析】A、b点是强碱溶液,因此溶液显碱性,A错误;B、d点溶液中水电离出的OH-离子浓度10-7mol/L,溶液呈中性,c(H+)=c(OH-),结合电荷守恒c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),两式相减,得c(K+)=2c(CO32-)+c(HCO3-),B正确;C、当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钾溶液,根据质子守恒可知c点溶液中:2c(H2CO3)+c(H+) +c(HCO3-) =c(OH-),C正确;D、水电离出的氢离子与氢氧根离子的浓度始终相等,a是没有通二氧化碳的情况,即pH=10的 KOH溶液,则c(H+)=1×10-10mol/L,而氢离子来源于水的电离,所以水电离出的c(H+)=1×10-10mol/L,D正确;答案选A。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目