题目内容
(1)一氧化碳和二氧化碳体积比为1:3的混合气体,此混合气体的密度是同温同压下氢气密度的
(2)将3.22g芒硝(Na2SO4?10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为
20
20
倍.(2)将3.22g芒硝(Na2SO4?10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为
34.2
34.2
g.分析:(1)由n=
=
可知,ρ=
=
,同温同压下,气体的密度之比等于相对分子质量之比;
(2)要使每100个水分子中溶有1个Na+,则水与钠离子的物质的量之比为100:1,注意水部分来自晶体.
| m |
| M |
| V |
| Vm |
| m |
| V |
| M |
| Vm |
(2)要使每100个水分子中溶有1个Na+,则水与钠离子的物质的量之比为100:1,注意水部分来自晶体.
解答:解:(1)混合气体的平均相对分子质量为
=40,
由n=
=
可知,ρ=
=
,同温同压下,气体的密度之比等于相对分子质量之比,则混合气体的密度是同温同压下氢气密度的
=20倍,
故答案为:20.
(2)n(Na2SO4?10H2O)=
=0.01mol,n(Na+)=0.02mol,则水的总物质的量为0.02mol×100=2mol,
其中晶体含结晶水的物质的量为0.01mol×10=0.1mol,
则需加水的物质的量为2mol-0.1mol=1.9mol,
所以水的质量为1.9mol×18g/mol=34.2g,
故答案为:34.2.
| 28+3×44 |
| 1+3 |
由n=
| m |
| M |
| V |
| Vm |
| m |
| V |
| M |
| Vm |
| 40 |
| 2 |
故答案为:20.
(2)n(Na2SO4?10H2O)=
| 3.22g |
| 322g/mol |
其中晶体含结晶水的物质的量为0.01mol×10=0.1mol,
则需加水的物质的量为2mol-0.1mol=1.9mol,
所以水的质量为1.9mol×18g/mol=34.2g,
故答案为:34.2.
点评:本题考查物质的量的相关计算,侧重于学生的计算能力的考查,有利于培养学习的学习积极,难度不大,注意相关计算公式的应用.

练习册系列答案
相关题目
 [化学--选修物质结构]
[化学--选修物质结构] (2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式 。
(2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式 。 (2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式 。
(2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式 。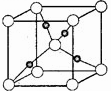 (2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式 。
(2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式 。 甲醇的沸点比甲醛的高,其主要原因是
;甲醛分子中碳原子轨道的杂化类型为
; 1mol甲醛分子中σ键的数目为 。
甲醇的沸点比甲醛的高,其主要原因是
;甲醛分子中碳原子轨道的杂化类型为
; 1mol甲醛分子中σ键的数目为 。