题目内容
甲同学设计以下实验制取氧气和氧化铜。
(1)制取氧气
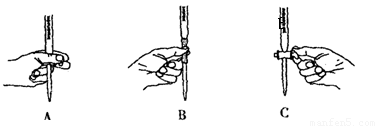
①用20%的H2O2溶液,通过反应2H2O2MnO22H2O+O2↑来制取氧气,则在下列A、B、C三装置中最佳装置是______
 |
②与气体发生装置相连接的D装置的导管口是______
③为了能使产生的氧气被充分干燥,可采取的操作是
_________________________________________________________________________________
(2)制取氧化铜
将m g铜粉在氧气流中加热到高温,使铜粉全部氧化,得n g粉末X。乙同学查阅资料知:铜与氧气的反应有:①2Cu+O2△\s\up2 (——2CuO,②4CuO>1000℃2Cu2O+O2↑;在酸性条件下:2Cu+(aq)——Cu(s)+
Cu2+(aq)。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物并不一定是纯CuO,可能含有一定量的氧化亚铜(Cu2O)。
(3)探究铜的氧化物的成分
为测定粉末X中是否含有Cu2O,甲、乙、丙三同学分别设计如下实验方案。
甲同学的实验方案是:向粉末X加入稀硫酸,若有 ,则说明固体中含有Cu2O。
乙同学的实验方案是:再将粉末X放入氧气中加热,如果其质量增加,则说明其中含有Cu2O。
丙同学的实验方案是:通过分析实验数据就可以确定粉末X的成分。
若n的取值范围是 ≤n<_____,则粉末X中含有Cu2O,其物质的量是___________。
请你再设计一个与上述三个实验方案中现象不同的实验方案,通过对化学反应和对实验现象的分析来确定粉末X中是否含有Cu2O。写出该实验中离子反应的方程式。
(1)①B (2分) ②b(1分) ③控制分液漏斗活塞,让液体慢慢滴入烧瓶中,使产生的气体缓缓通过D装置(2分)。
(3)红色不溶于水的固体生成(1分); ≤n<(1分);mol(1分)
向粉末x中加入足量浓HNO3,若有红棕色气体产生,则说明固体中含有Cu2O(2分);反应的离子方程式为:CuO+2H+=Cu2++H2O,Cu2O+6H++2-3=2Cu2++2NO2↑+3H2O(2分)
关于元素化合物的试题,还要注意从框图中发现问题,从物质间的关系上发现问题,有变价、既能与酸反应又能与碱反应的物质在试题中往往成为热点,要注意它们的特点。如我市在一模及其反馈考试、二模中考过的试题外(请再复习),还要注意氧化还原反应在元素推断中的体现。
解析:
(1)①根据反应原理中反应物的状态(固体+液体)和反应条件(不需要加热)可以排除A(A装置适合于固体物质加热),而C中固体与液体直接混合,难以控制反应中气体产生的速率和量,因而最佳装置为B。从实验要求上讲,凡是有毒的气体、反应速率较高的气体的制备,一般都要求反应可控,方法是控制液体加入量。再,水浴加热也是控制反应的一种方法。要注意的是,固体与液体的反应,一般要求是先加固体再加液体,否则反应将失去控制,如氢氧化钠固体与氨水的反应。
②反应产生的O2中可能混有水蒸气杂质,除去水蒸气时应从D装置的b口进,即“长进短出”。如果反过来,成了得排液装置,常用于量气体的体积。
 ③要使产生的氧气被充分干燥,一般有两种方案,一是通过操作的控制来控制反应速率,即控制分液漏斗的活塞,让液体慢慢滴入烧瓶中,使反应中产生的O2缓慢通过D装置,与浓H2SO4充分接触而被干燥,这是本题的答案。再一种方案是通过改造仪器装置,增大气体与浓硫酸的接触面积。通常的作法是在导管口接上一个多孔的小空心球,形状见右图,此物曾在高考中考过。
③要使产生的氧气被充分干燥,一般有两种方案,一是通过操作的控制来控制反应速率,即控制分液漏斗的活塞,让液体慢慢滴入烧瓶中,使反应中产生的O2缓慢通过D装置,与浓H2SO4充分接触而被干燥,这是本题的答案。再一种方案是通过改造仪器装置,增大气体与浓硫酸的接触面积。通常的作法是在导管口接上一个多孔的小空心球,形状见右图,此物曾在高考中考过。
以上属于实验仪器和实验操作方面的内容,此次考查这部分内容也是对我市前几次实验考查内容的补全。
(3)甲同学的方案是直接应用信息,对方程式进行分析的结果――酸性条件――加入稀H2SO4――有金属铜产生――若反应中若有红色不溶固体生成,则说明固体中含有Cu2O。
丙同学方案的计算核心是铜守恒,n(Cu)—— n(CuO)——2 n(Cu2O)。
若X全部为Cu2O,则粉末X质量为:××144——g;
若X全部为CuO,则粉末X质量为:×80——g。
因而,n的取值范围是≤n<(有可能完全是氧化铜,所以用≤;既然含有Cu2O就不可能完全是CuO,所以用<)。
n(Cu2O)的计算方法:在化学中计算一般是列等式,实际上就是等量,就是守恒的一种表达形式。在本题中一是有铜守恒,二是有铜的两种氧化物的质量等于n g。所以有
解得:n(Cu2O)—— mol。
新的实验方案应该用新的思路。一般人们的思路是看信息表面(如甲同学),但是,设计实验首先要的就是被检验物质的性质。化学性质主要有两类,一类是从酸、碱、盐的角度去考虑,甲同学已经考虑过了。二是从氧化还原反应角度去考虑,亚铜中铜是+1价,所以有还原性,所以可以用氧化剂反应,只有要明显的颜色变化就行。所以用答案:向粉末x中加入足量浓HNO3,若有红棕色气体产生,则说明固体中含有Cu2O。该实验的特点是有明显的现象。另外两种情况的考虑:①用酸性高锰酸钾溶液。如果粉末中氧化亚铜的含量少,不能使其全部褪色,就很难下结论。②用氯化铁溶液。由于氯化铁溶液是强酸性的,当与CuO反应pH升高到一定程度时,氯化铁的水解作用就会产生红褐色沉淀,而自身颜色也褪去,所以无法判断。再:用稀浓硝酸也是一种选择,但考虑产生要与CuO反应,一定会大量消耗硝酸,另外从还原产生的气体题看,产生NO的量NO2量的三分之一,既使变红棕色也不如浓硝酸明显。
应该说,新实验方案如果是凭印象选择了浓硝酸说明元素知识比较熟练,但如果是从氧化还原反应的观点来分析和选择的话,说明了一定的化学境界。
本题从知识的角度讲,考查了铜及其重要化合物的性质,考查了硝酸的性质,考查了离子方程式的书写。从化学思想方法角度讲,考查了对氧化还原反应原理的理解与应用。从能力角度讲,考查了接受并应用新信息的能力,符合考试说明的要求。
需要再说的几点:①如果仅是描述实验现象的话,应该说到粉末逐渐溶解,溶液逐渐变为绿色。
②本实验是一个验证性实验,所以结论应该是两种情况,如果是…,如果不是…。但在本题中前三个同学的方案已经给了模式,此问只要说出有Cu2O的现象就行了。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案
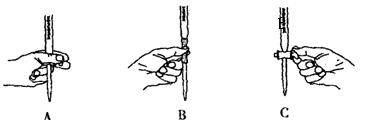
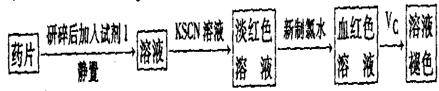
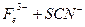

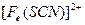 。
。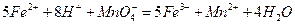 。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。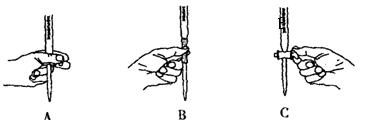
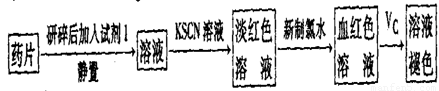
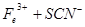
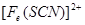 。
。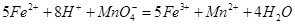 。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。