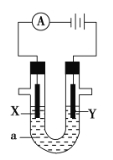
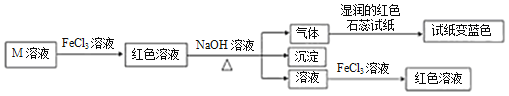
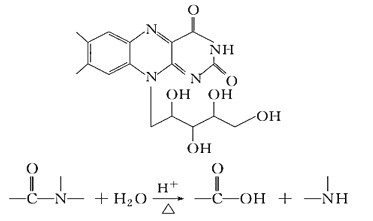
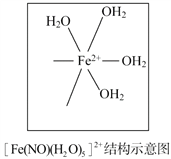
��Ŀ����
����Ŀ������ƽ�����ʢ��ǿ��ԭ��Һ̬�£�N2H4����ǿ������Һ̬˫��ˮ������0.4molҺ̬�º�0.8mol H2O2��Ϸ�Ӧ�����ɵ�����ˮ�������ų�260 kJ������(�൱��25�桢101kPa�²�õ�����)��
��1����Ӧ���Ȼ�ѧ����ʽΪ___________��
��2������֪H2O(l) = H2O(g) ��H= +44kJ/mol����16gҺ̬����Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų���������_____kJ��
��3���˷�Ӧ���ڻ���ƽ������ŵ��ǣ����ٴ����㣩________��
���𰸡�N2H4(l)+2H2O2(l) = N2(g) +4H2O(g) ��H=��650 kJ/mol 413 �ͷŴ����ȺͿ��ٲ������������⣬���ﲻ����ɻ�����Ⱦ
��������
��1�����ݷ�Ӧ�����������ƽ��д��ѧ����ʽ�����ݶ�����ϵ�жϣ�0.4molҺ̬�º�0.8mol H2O2���ǡ�÷�Ӧ������1molҺ̬����ȫ��Ӧ�ų�650kJ��������
��2��H2O��l��=H2O��g����H=+44kJ/mol�����ݸ�˹���ɼ�������õ���
��3�����ݲ����ж�������������Ⱦ��
��1����Ӧ����ʽΪ��N2H4+2H2O2=N2+4H2O��0.4molҺ̬����0.8molH2O2ǡ����ȫ��Ӧ�ų�260 kJ����������1molҺ̬�·ų�������Ϊ![]() =650kJ�����Է�Ӧ���Ȼ�ѧ����ʽΪ��N2H4��l��+2H2O2��l��=N2��g��+4H2O��g����H=-650 kJ/mol��
=650kJ�����Է�Ӧ���Ȼ�ѧ����ʽΪ��N2H4��l��+2H2O2��l��=N2��g��+4H2O��g����H=-650 kJ/mol��
��2����N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-650kJ/mol����H2O��l��=H2O��g����H=+44kJ/mol�����ݸ�˹���ɢ�-����4�õ�N2H4��l��+2H2O2��l���TN2��g��+4H2O��l����H=-826kJ/mol��16gҺ̬�����ʵ���=![]() =0.5mol������16gҺ̬����Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų���������413kJ��
=0.5mol������16gҺ̬����Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų���������413kJ��
��3���˷�Ӧ���ڻ���ƽ����ͷŴ����ȺͿ��ٲ����������壬����Ϊ������ˮ���ǿ����ɷֲ�����ɻ�����Ⱦ��