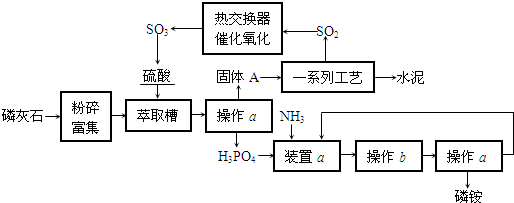
题目内容
(15分)在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
(1)铜与浓硫酸反应,实验装置如图所示。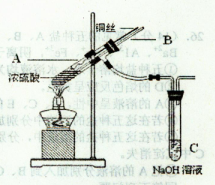
①装置A中发生反应的化学方程式为 ;
②上图装置中导管B的作用你认为可能是(写出一种) 。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在 (填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过 、 、过滤、洗涤、干燥,即可得到产品CuSO4·5H2O晶体,干燥需要控制温度小于100℃,若温度过高,则会导致 。
(3)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量:FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu=2Fe2++Cu2+,请写出其第l步反应的离子方程式 。
(4)制取的CuSO4溶液和“另一物质”在40-50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 ,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是 (已知Cu+在酸性条件下发生反应2Cu+=Cu2++Cu)。
(1)①2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O (2分)
CuSO4+SO2↑+2H2O (2分)
②安全管;平衡气压;防倒吸;若连C的导气管堵塞时防止装置爆炸;拆除装置前,从B管口向A中鼓气使SO2被全部吸收。(写出一种即得分) (2分)
(2)坩埚 蒸发浓缩(加热蒸发) 冷却结晶 CuSO4·5H2O失去部分结晶水(各1分,共4分)
(3)4Fe2++O2+4H+=4Fe3++2H2O (2分)
(4)H2 (2分) 0.75 mol (3分)
解析