题目内容
(2012?石家庄模拟)在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g)?E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol?L-1.下列说法正确的是( )
分析:A、依据概念计算,转化率=
×100%;
B、依据反应速率=
计算得到;
C、恒温恒容容器中加入惰气,总压增大,分压不变,平衡不动;
D、依据极值分析法,反应从开始到平衡的过程中,正反应速率越来越小,当进行2min时,M浓度的变化值大于0.4mol?L-1,所以2min时,M的物质的量浓度应小于0.6mol?L-1;
| 反应物消耗量 |
| 起始量 |
B、依据反应速率=
| △c |
| △t |
C、恒温恒容容器中加入惰气,总压增大,分压不变,平衡不动;
D、依据极值分析法,反应从开始到平衡的过程中,正反应速率越来越小,当进行2min时,M浓度的变化值大于0.4mol?L-1,所以2min时,M的物质的量浓度应小于0.6mol?L-1;
解答:解:A、反应开始时,M的浓度为
=1mol/L,平衡时为0.2mol?L-1,转化了0.8mol?L-1,M转化率为80%.故A正确;
B、4min时,用M表示的反应速率为
=0.2mol?L-1?min-1,故B错误;
C、恒温恒容下,充入不反应的稀有气体,各组分的浓度没有发生变化,所以正逆反应速率不变,平衡不移动,M的物质的量不变;故C错误;
D、反应从开始到平衡的过程中,正反应速率越来越小,当进行2min时,M浓度的变化值大于0.4mol?L-1,所以2min时,M的物质的量浓度应小于0.6mol?L-1,故D错误;
故选A.
| 2mol |
| 2L |
B、4min时,用M表示的反应速率为
| 0.8mol/L |
| 4min |
C、恒温恒容下,充入不反应的稀有气体,各组分的浓度没有发生变化,所以正逆反应速率不变,平衡不移动,M的物质的量不变;故C错误;
D、反应从开始到平衡的过程中,正反应速率越来越小,当进行2min时,M浓度的变化值大于0.4mol?L-1,所以2min时,M的物质的量浓度应小于0.6mol?L-1,故D错误;
故选A.
点评:本题考查化学平衡的计算应用,主要是反应速率、反应物的转化率、影响平衡条件分析判断,极值判断是解题关键,题目难度中等.

练习册系列答案
相关题目

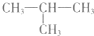 (2012?石家庄一模)2-甲基丙烷(如图)的二氯代物共有(不考虑立体异构)( )
(2012?石家庄一模)2-甲基丙烷(如图)的二氯代物共有(不考虑立体异构)( )