题目内容
【题目】25℃时,向20mL 0.1mol/LH2R(二元弱酸)溶液中滴加0.1mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系如图所示。下列有关说法正确的是
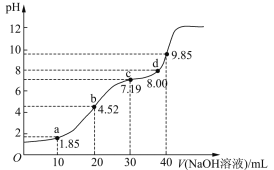
A. a点所示溶液中:c (H2R) + c (HR-)+ c (R2-)=0.lmol/L
B. b点所示溶液中:c (Na+) >c(HR-)> c (H2R)>c(R2-)
C. 对应溶液的导电性:b > c
D. a、b、c、d中,d点所示溶液中水的电离程度最大
【答案】D
【解析】A、a点所示溶液中:c (H2R) + c (HR-)+ c (R2-)= ![]() mol·L-1,故A错误;B、b点所示溶液相当于Na2R,R2― 部分水解生成HR― ,HR― 再水解生成H2R,故c (Na+) >c(R2-)>c(HR-)> c (H2R),B错误;C、溶液的导电性强弱与溶液中阴阳离子的浓度大小和离子所带的电荷数有关系,c点溶液中离子浓度大,对应溶液的导电性:b < c,故C错误;D、a、b抑制水电离,c点PH=7,不影响水电离,d点促进水电离,故D正确;故选D。
mol·L-1,故A错误;B、b点所示溶液相当于Na2R,R2― 部分水解生成HR― ,HR― 再水解生成H2R,故c (Na+) >c(R2-)>c(HR-)> c (H2R),B错误;C、溶液的导电性强弱与溶液中阴阳离子的浓度大小和离子所带的电荷数有关系,c点溶液中离子浓度大,对应溶液的导电性:b < c,故C错误;D、a、b抑制水电离,c点PH=7,不影响水电离,d点促进水电离,故D正确;故选D。

练习册系列答案
相关题目