题目内容
下列说法不正确的是( )
| A、MnO2能加速H2O2的分解,是因为MnO2可以降低反应所需的活化能 |
| B、向橙色的K2Cr2O7溶液中滴加NaOH溶液,溶液颜色变黄,说明化学平衡发生了移动 |
| C、将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深,这一事实可以用勒夏特列原理解释 |
| D、FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
考点:反应热和焓变,化学平衡的影响因素,盐类水解的应用
专题:基本概念与基本理论
分析:A、催化剂通过降低反应的活化能加快反应速率;
B、在K2Cr2O7的溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,加碱中和氢离子,平衡正向移动;
C、2N02?N2O4 △H<0,N2O4无色;
D、Fe2(SO4)3溶液蒸干灼烧,所得固体仍为Fe2(SO4)3,因为硫酸没有挥发性.
B、在K2Cr2O7的溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,加碱中和氢离子,平衡正向移动;
C、2N02?N2O4 △H<0,N2O4无色;
D、Fe2(SO4)3溶液蒸干灼烧,所得固体仍为Fe2(SO4)3,因为硫酸没有挥发性.
解答:
解:A、催化剂通过降低反应的活化能加快反应速率,MnO2是H2O2分解的催化剂,故A正确;
B、在K2Cr2O7的溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,加碱中和氢离子,平衡正向移动,溶液颜色变黄,故B正确;
C、2N02?N2O4 △H<0,N2O4无色,加热平衡正向移动,气体颜色变浅,故C正确;
D、氯化铁溶液和硫酸铁溶液都会水解,分别生成盐酸和硫酸,盐酸易挥发,而硫酸不挥发,所以,氯化铁蒸干时随盐酸的挥发氢氧化铁沉淀出来,灼烧得到氧化铁,而硫酸不挥发,最后还是硫酸铁,故D正确.
故选:D.
B、在K2Cr2O7的溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,加碱中和氢离子,平衡正向移动,溶液颜色变黄,故B正确;
C、2N02?N2O4 △H<0,N2O4无色,加热平衡正向移动,气体颜色变浅,故C正确;
D、氯化铁溶液和硫酸铁溶液都会水解,分别生成盐酸和硫酸,盐酸易挥发,而硫酸不挥发,所以,氯化铁蒸干时随盐酸的挥发氢氧化铁沉淀出来,灼烧得到氧化铁,而硫酸不挥发,最后还是硫酸铁,故D正确.
故选:D.
点评:本题考查了催化剂的催化原理、盐类水解平衡移动、化学平衡移动等,有一定难度,注意平时学习过程中的比较.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
下列说法正确的是( )
| A、油脂和蛋白质均属于高分子化合物 |
| B、二氧化硅是太阳能电池的主要材料 |
| C、Na、C、S都能直接与氧气反应,生成两种相应的氧化物 |
| D、蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 |
对于反应N2+3H2?2NH3,下列说法处于化学平衡状态的是( )
①υ(N2生成)=υ(N2消耗)
②N2、H2、NH3的分子数之比为1:3:2
③单位时间内生成2mol NH3,同时消耗1mol N2
④N2、H2、NH3的物质的量不再发生变化.
①υ(N2生成)=υ(N2消耗)
②N2、H2、NH3的分子数之比为1:3:2
③单位时间内生成2mol NH3,同时消耗1mol N2
④N2、H2、NH3的物质的量不再发生变化.
| A、①④ | B、②③ |
| C、②③④ | D、①③④ |
下列物质的包装箱应贴上如图标识的是( )


| A、纯碱 | B、汽油 | C、浓硫酸 | D、氨水 |
某烃1mol最多能和2mol HBr加成反应,其所得的产物又能跟8mol Br2发生取代反应,最后得到一种只含碳、溴两种元素的化合物,则原烃为( )
| A、C2H2 |
| B、C3H4 |
| C、C3H6 |
| D、C4H6 |
某溶液中加入铝粉能产生氢气,在该溶液中一定能大量共存的离子组是( )
| A、Na+、K+、Cl-、SO42- |
| B、Cu2+、Fe2+、NO3-、SO42- |
| C、Na+、Ca2+、Cl-、ClO- |
| D、K+、NH4+、Cl-、SO42- |
关于氧化还原反应,下列说法不正确的是( )
| A、一定存在着元素化合价变化 |
| B、一定有单质参加反应 |
| C、氧化反应和还原反应同时发生 |
| D、一定存在着电子转移 |
下列有机化合物中含碳量最大的是( )
| A、甲烷 | B、乙烷 | C、乙烯 | D、苯 |
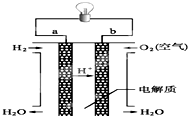 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.