题目内容
含MgCl2、KCl、Na2SO4三种物质的混合溶液。已知其中含Cl- 0.5
mol,K+和Na+共0.5 mol,Mg2+ 0.5 mol,则 的物质的量为________。
的物质的量为________。
有体积相同的某植物营养液两份,其配方如下:
(1)0.3 mol KCl、0.2 mol K2SO4和0.1 mol ZnSO4;
(2)0.1 mol KCl、0.3 mol K2SO4和一定物质的量的ZnCl2。
若使两份营养液中各离子的物质的量均相等,则第(2)份营养液中ZnCl2的物质的量为________。
【答案】
0.5 mol 0.1 mol
【解析】
试题分析:(1)根据溶液中电荷守恒可得0.5 mol×1+n(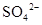 )×2=0.5 mol×2+0.5 mol×1,解得n(
)×2=0.5 mol×2+0.5 mol×1,解得n(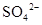 )=0.5 mol。
)=0.5 mol。
(2)由锌原子守恒可得n(ZnCl2)=0.1 mol。
考点:考查溶液中离子物质的量的有关计算
点评:该题是基础性试题的考查,试题贴近高考,基础性强,侧重考查学生分析问题、解决问题的能力。该题的关键是利用好守恒法在化学计算中的重要应用,有利于培养学生的规范答题能力,有利于提高学生的应试能力。

练习册系列答案
相关题目


