题目内容
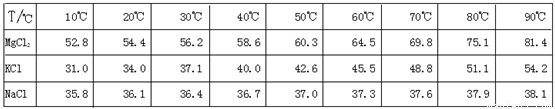
在含MgCl2、KCl和Na2SO4三种物质的混合溶液中,已知:c(Cl-)=1.5 mol.L-1,c(SO42-)=0.5 mol.L-1, c(K+)+c(Na+)=1.5 mol.L-1,则c(Mg2+)应是( )A.0.1 mol.L-1 B.1.5 mol.L-1 C.0.25 mol.L-1 D.0.5mol.L-1
答案:D
提示:
提示:
| 在MgCl2、KCl、Na2SO4的混合溶液中,存在着金属离子与酸根离子的如下关系:
Mg2+ ~ 2Cl-,K+ ~ Cl-,2Na+ ~ SO42-。据题意和上述离子物质的量浓度的关系,由c(SO42-)可求c(Na+),由c(Cl-)、c(K+)+c(Na+)的关系可求出c(Mg2+)为0.5mol.L-1,但这种方法容易在导出过程中出错。较为简便的方法是:利用混合溶液中各种阴、阳离子的正负电荷的总数为零,溶液呈电中性列等式:(设溶液为V L)。 V×c(Mg2+)×2+V×c(K+)×1+V×c(Na+)×1=V×c(Cl-)×1+V×c(SO42-)×2 2 c(Mg2+)+(c(K+)+c(Na+))=c(Cl-)+2 c(SO42-), ∴c(Mg2+)=(1.5+0.5×2-1.5)×2=0.5 mol.L-1。
|

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目