题目内容
【题目】设NA为阿佛加德罗常数
(1)4.9g硫酸中含有mol H原子,个O原子和个S原子,与克H2O中所含O原子数相等,溶于水配成500mL溶液其物质的量浓度为 .
(2)同温同压下,体积相等的CO和CO2的分子数之比为 , 物质的量之比为 , 原子数之比为 , 质量之比为 ,
(3)某金属氯化物MCl227g,含有0.40molCl﹣ , 则该氯化物的物质的量为 , 摩尔质量为 , 金属M的相对原子质量为 .
【答案】
(1)0.1;0.2NA;0.05NA;3.6;0.1mol/L
(2)1:1;1:1;2:3;7:11
(3)0.2mol;135 g/mol;64
【解析】解:(1)4.9g硫酸的物质的量是0.05mol,每个硫酸分子中含有2个H原子、4个O原子,则0.05mol硫酸分子中含有H原子的物质的量为:0.05mol×2=0.1mol;含有O原子的物质的量为0.05mol×4=0.2mol,根据N=nNA知,含有O原子个数为0.2NA;S原子个数为0.05NA;
每个水分子中含有1个O原子,则硫酸和水中O原子个数相等时硫酸和水的物质的量之比为1:4,水的质量m=nM=0.05mol×4×18g/mol=3.6g;
c= ![]() =
= ![]() =0.1mol/L;
=0.1mol/L;
所以答案是:0.1;0.2NA;0.05NA;3.6;0.1mol/L;(2)根据阿伏伽德罗定律可知,同温同压下同体积的CO2和CO的物质的量相同,物质的量之比为1:1,
设CO2和CO的物质的量都为1mol,
则根据N=nNA可知:气体的分子数之比等于物质的量之比,为1:1;
1个CO中含有2个原子,1个CO2中含有3个原子,则原子数之比为1×2:1×3=2:3,
1molCO的质量为1mol×28g/mol=28g,1molCO2的质量为1mol×44g/mol=44g,质量之比为28:44=7:11,
因CO2和CO的体积相同,则密度之比等于质量之比,为11:7,
所以答案是:1:1;1:1;2:3;7:11;(3)根据化学式知,含有0.40molCl﹣的该化合物物质的量= ![]() =0.20mol,该化合物的摩尔质量M=
=0.20mol,该化合物的摩尔质量M= ![]() =
= ![]() =135g/mol,化合物的相对分子质量在数值上等于其摩尔质量,所以该化合物的相对分子质量是135,则R的相对原子质量=135﹣35.5×2=64,
=135g/mol,化合物的相对分子质量在数值上等于其摩尔质量,所以该化合物的相对分子质量是135,则R的相对原子质量=135﹣35.5×2=64,
所以答案是:0.2mol;135 g/mol;64.

【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。

实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。
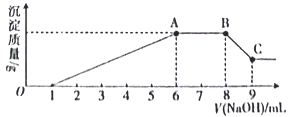
回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。