题目内容
某金属氧化物MO2于高温下用碳还原,得到标准状况下400毫升的一氧化碳、100毫升二氧化碳和0.978克金属M,则M的摩尔质量为________.
73g/mol
分析:根据氧元素守恒可知,2n(MO2)=n(CO)+2n(CO2),根据金属M守恒可知n(M)=n(MO2),据此计算计算的物质的量,再根据M= 计算金属的摩尔质量.
计算金属的摩尔质量.
解答:根据氧元素守恒可知,2n(MO2)=n(CO)+2n(CO2)=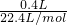 +2×
+2× ,
,
所以n(MO2)=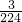 mol,根据金属M守恒可知n(M)=n(MO2)=
mol,根据金属M守恒可知n(M)=n(MO2)=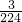 mol,
mol,
则M的摩尔质量为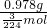 =73g/mol.
=73g/mol.
故答案为:73g/mol.
点评:考查摩尔质量、物质的量的计算等,难度不大,根据氧元素守恒计算金属氧化物的物质的量是解题关键.
分析:根据氧元素守恒可知,2n(MO2)=n(CO)+2n(CO2),根据金属M守恒可知n(M)=n(MO2),据此计算计算的物质的量,再根据M=
 计算金属的摩尔质量.
计算金属的摩尔质量.解答:根据氧元素守恒可知,2n(MO2)=n(CO)+2n(CO2)=
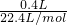 +2×
+2× ,
,所以n(MO2)=
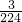 mol,根据金属M守恒可知n(M)=n(MO2)=
mol,根据金属M守恒可知n(M)=n(MO2)=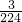 mol,
mol,则M的摩尔质量为
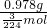 =73g/mol.
=73g/mol.故答案为:73g/mol.
点评:考查摩尔质量、物质的量的计算等,难度不大,根据氧元素守恒计算金属氧化物的物质的量是解题关键.

练习册系列答案
相关题目