题目内容
|
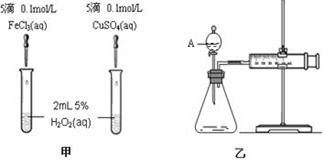
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验.下列叙述中不正确的是
| |
| [ ] | |
A. |
图1实验可以通过观察产生气泡快慢来比较反应速率的大小 |
B. |
若图1所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果 |
C. |
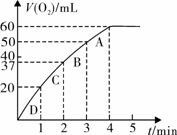
用图2装置测定反应速率,可测定反应产生的气体体积及时间 |
D. |
为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |

 新非凡教辅冲刺100分系列答案
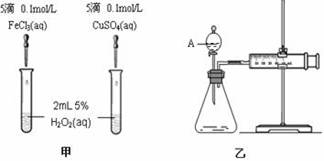
新非凡教辅冲刺100分系列答案为比较Fe3+和Cu2+对H2O2分解的催化效果,甲、乙同学分别设计了如图一、图二所示的实验。
(1) H2O2分解的化学方程式为 。
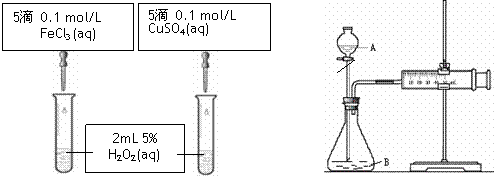 |
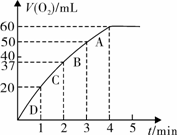
图一 图二
(2)图一所示实验能定性说明反应快慢的依据是 _______________________________;
图二所示实验能说明反应快慢的数据是____________________________________。
(3)① 用H2O2和H2SO4的混合溶液可溶解印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H= + 64.39 kJ/mol
2H2O2(l)=2H2O(l) + O2(g) △H= ﹣196. 46 kJ/mol
H2(g) + 1/2O2(g) = H2O(l) △H= ﹣285. 84 kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+ 和H2O的热化学方程式为:
。
② 控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3 .0 mol/L H2SO4的混
合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 (×10—3 mol·L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因
是 。