题目内容
【题目】Ⅰ.按要求填空
(1)5.4gH2O物质的量为____________mol,约含有___________________个原子;
(2)已知1.204×1023个X气体的质量是6.4g。则X气体的摩尔质量是_________ g/mol;
(3)同温同压下,同体积的甲烷CH4和CO2质量之比为________,质子数之比_______;
(4)VLAl2(SO4)3溶液中含Al3+ag,该Al2(SO4)3溶液的物质的量浓度为_____mol/L,取出![]() L再加入水稀释到4VL。则稀释后溶液中SO42-的物质的量浓度是_____mol/L。
L再加入水稀释到4VL。则稀释后溶液中SO42-的物质的量浓度是_____mol/L。
Ⅱ.按要求书写下列反应的方程式
(1)亚硫酸氢钠电离方程式(NaHSO3)________________________________________________;
(2)醋酸溶液与NaHCO3溶液反应的离子方程式为________________________________;
(3)0.8molL﹣1NaHSO4与0.4molL﹣1Ba(OH)2溶液等体积混合,反应的离子方程式为___________;
(4)黑火药爆炸的化学方程式为________________________________。
Ⅲ.请配平以下化学方程式
(1)____FeSO4+____K2O2+____H2O =____ Fe(OH) 3+____ Fe2(SO4) 3+____KOH
(2)_____BiO3-+_____Mn2++____=_____Bi3++_____ MnO4- +____
【答案】0.3 0.9×6.02×1023或0.9 NA 32g/mol 4:11 5:11 ![]() mol/L
mol/L ![]() mol/L NaHSO3=Na++HSO3- CH3COOH+HCO3- =CO2↑+CH3COO-+H2O Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O S+2KNO3+3C
mol/L NaHSO3=Na++HSO3- CH3COOH+HCO3- =CO2↑+CH3COO-+H2O Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O S+2KNO3+3C ![]() K2S+N2↑+3CO2↑ 6 3 6 2 2 6 5 2 14H+ 5 2 7H2O
K2S+N2↑+3CO2↑ 6 3 6 2 2 6 5 2 14H+ 5 2 7H2O
【解析】
Ⅰ.根据n=![]() =
=![]() =
=![]() =cV进行计算;
=cV进行计算;
Ⅱ.(1)亚硫酸氢钠为强电解质,在溶液中完全电离出钠离子和亚硫酸氢根离子;
(2)亚硫酸氢钠与醋酸反应生成醋酸钠、水、二氧化碳;
(3)根据反应的方程式书写;
(4)根据反应的方程式书写;
Ⅲ.根据电子得失守恒、电荷守恒以及原子守恒分析解答。
Ⅰ.(1)根据n=![]() 可知,5.4gH2O物质的量为
可知,5.4gH2O物质的量为![]() =0.3mol,约含有0.3mol×3×NA/mol=0.9 NA= 0.9×6.02×1023个原子;
=0.3mol,约含有0.3mol×3×NA/mol=0.9 NA= 0.9×6.02×1023个原子;
(2)已知1.204×1023个X气体的质量是6.4g,X气体的物质的量是![]() =0.2mol,所以X气体的摩尔质量是
=0.2mol,所以X气体的摩尔质量是![]() =32g/mol;
=32g/mol;
(3)同温同压下,根据阿伏加德罗定律可知同体积的甲烷(CH4)和CO2分子数之比为1:1,物质的量之比1:1,质量之比为1mol×16g/mol:1mol×44 g/mol=4:11;质子数之比为(6+1×4):(6+8×2)=5:11;
(4)VLAl2(SO4)3溶液中含Al3+ ag,则Al3+的物质的量为![]() =
=![]() mol,硫酸铝的物质的量是
mol,硫酸铝的物质的量是![]() mol =
mol =![]() mol ,所以溶液的物质的量浓度为
mol ,所以溶液的物质的量浓度为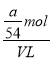 =
=![]() mol/L;取出
mol/L;取出![]() L再加入水稀释到4VL。则稀释后溶液中SO42-的物质的量浓度是
L再加入水稀释到4VL。则稀释后溶液中SO42-的物质的量浓度是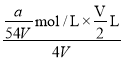 ×3=
×3=![]() mol/L;
mol/L;
Ⅱ.(1)亚硫酸氢钠在溶液中完全电离出钠离子和亚硫酸氢根离子,电离方程式为:NaHSO3=Na++HSO3-;
(2)亚硫酸氢钠与醋酸反应生成醋酸钠、水、二氧化碳,发生的离子反应为CH3COOH+HCO3- =CO2↑+CH3COO-+H2O;
(3)0.8molL﹣1NaHSO4与0.4molL﹣1Ba(OH)2溶液等体积混合,即NaHSO4与Ba(OH)2按照物质的量2:1反应,氢离子与氢氧根离子恰好反应,反应的离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(4)黑火药爆炸是硫、硝酸钾和碳反应生成硫化钾、氮气和二氧化碳,反应的化学方程式为S+2KNO3+3C ![]() K2S+N2↑+3CO2↑;
K2S+N2↑+3CO2↑;
Ⅲ.(1)FeSO4中的Fe元素由+2→+3,升高1,而K2O2的O元素由-1→-2,降低1×2,两者最小公倍数为2,根据电荷守恒以及原子守恒可知反应的方程式为6FeSO4+3K2O2+6H2O =2Fe(OH) 3+2Fe2(SO4) 3+6KOH;
(2)Mn2+中的Mn元素由+2→+7,升高5,而BiO3-的Bi元素由+5→+3,降低2,两者最小公倍数为10,根据电荷守恒以及原子守恒可知反应的方程式为5BiO3-+2Mn2++14H+=5Bi3++2MnO4- +7 H2O。

【题目】抗爆剂的添加剂常用1,2-二溴乙烷。如图为实验室制备1,2-二溴乙烷的装罝图, 图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。

已知:CH3CH2OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,请写出发生堵塞时瓶b中的现象:①_______________;如果实验时d装罝中导管堵塞,你认为可能的原因是②_______________;安全瓶b还可以起到的作用是③_______________。
(2)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_____________________。
(3)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装罝的气密性没有问题,试分析可能的原因:______________、______________(写出两条即可)。
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为___________,要进一步提纯,下列操作中必需的是_____________ (填字母)。
A.重结晶 B.过滤 C.萃取 D.蒸馏
(5)实验中也可以撤去d装罝中盛冰水的烧杯,改为将冷水直接加入到d装罝的试管中,则此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是______。