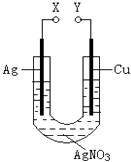
题目内容
【题目】已知室温下,0.1molL﹣1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.HA电离出的c(H+)与水电离出的c(H+)之比为108
B.升高温度,溶液的pH减小
C.溶液的pH=4
D.HA的电离平衡常数约为l×10﹣7
【答案】A
【解析】解:A.HA电离出的c(H+)为0.1mol/L×0.1%=10﹣4mol/L,水电离产生的氢离子浓度为10﹣10mol/L,则由HA电离出的c(H+)约为水电离出的c(H+)的106倍,故A错误; B.温度升高促进弱酸的电离,氢离子浓度变大,则pH变小,故B正确;
C.HA电离出的c(H+)为0.1mol/L×0.1%=10﹣4mol/L,则pH=﹣lg(10﹣4)=4,故C正确;
D.由HAH++Ac﹣ , c(H+)=c(Ac﹣)=10﹣4mol/L,则电离平衡常数为 ![]() =1×10﹣7 , 故D正确;
=1×10﹣7 , 故D正确;
故选A.
【考点精析】关于本题考查的弱电解质在水溶液中的电离平衡,需要了解当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能得出正确答案.

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1)a.配制待测液:称取4.1g固体烧碱样品(杂质不与酸反应)配制成250mL溶液. b.滴定
①用量取10.00mL待测液.
②向锥形瓶中加入几滴酚酞,用0.201 0molL﹣1的标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到时停止滴定.
(2)数据处理
实验次 | 盐酸溶液体积 | 氢氧化钠溶液体积 |
1 | 19.90 | 10.00 |
2 | 20.10 | 10.00 |
3 | 22.00 | 10.00 |
4 | 20.00 | 10.00 |
根据上述表格,选取合适的数据,计算待测烧碱溶液的浓度为 , 烧碱的纯度为(保留两位小数).
(3)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配制盐酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是(多选)
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏
B.如果实验中需用80mL的稀盐酸标准溶液,配制时应选用100mL容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的NaOH溶液的浓度将偏大
E.配制溶液时,定容时俯视读数,则导致实验结果偏大
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大
G.锥形瓶用蒸馏水洗浄后,有少量蒸馏水残留,则导致实验结果偏小
H.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则导致实验结果偏大.