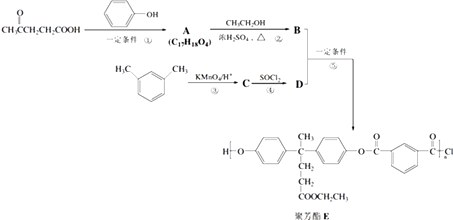
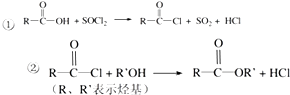
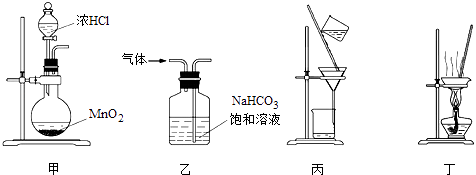
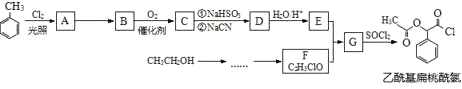
��Ŀ����
����Ŀ����֪��I2��aq��+I����aq��I3����aq����ijI2��KI��Һ�У�c��I3�������¶ȣ�T���Ĺ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������˵����ȷ���ǣ� �� 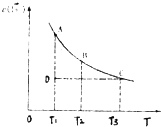
A.��ӦI2��aq��+I����aq��I3����aq����H��0
B.״̬A��c ��I2����״̬D��С
C.A���Ӧ�ķ�Ӧ���ʴ���C���Ӧ�ķ�Ӧ����
D.�����������䣬����Һ�м���KI���壬ƽ����C���ƶ���D��
���𰸡�B
���������⣺A����ͼ�����ߵı仯���ƿ�֪�����¶�����ʱ��I3�������ʵ���Ũ�ȼ�С��ƽ�������ƶ���˵���÷�Ӧ������ӦΪ���ȷ�Ӧ����ӦI2��aq��+I����aq��I3����aq���ġ�H��0����A����
B��D�������A�����I3����Ũ�Ƚ�С����СI3����Ũ�ȣ���ѧƽ�������ƶ���c ��I2������B��ȷ��
C��C���Ӧ���¶ȴ���A�㣬�¶�Խ��ѧ��Ӧ����Խ�죬��C����
D�������������䣬����Һ�м���KI���壬������I����Ũ�ȣ�ƽ�������ƶ���I3����Ũ������D����
��ѡB��
�����㾫�������ջ�ѧƽ��״̬���ʼ������ǽ����ĸ�������Ҫ֪����ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����