题目内容
5.下列有关原电池的判断错误的是( )①所有金属都能作电极
②有活泼性不同的两种金属电极、有电解质溶液、导线就一定能构成原电池,对外放电
③原电池放电实现化学能转化为电能
④以铁、铜为电极,在稀硫酸溶液中构成原电池,负极反应式为Fe-3e-═Fe3+.
| A. | ①② | B. | ①③ | C. | ①②④ | D. | ①②③④ |
分析 ①活泼的金属易与水反应的,不能作电极;
②根据原电池的构成条件分析;
③原电池是将化学能转化为电能的装置;
④原电池中Fe作负极失电子生成亚铁离子.
解答 解:①活泼的金属易与水反应,不能作电极,故错误;
③原电池的构成条件①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,若有活泼性不同的两种金属电极、有电解质溶液、导线,如果不能自发发生氧化还原反应,则不能形成原电池,故错误;
③原电池反应中能自发的进行氧化还原反应,是将化学能转化为电能的装置,故正确;
④以铁、铜为电极,在稀硫酸溶液中构成原电池,Fe作负极失电子生成亚铁离,负极反应式为Fe-2e-═Fe2+,故错误;
故选C.
点评 本题考查了原电池的构成和电极方程式的判断,属于基础性试题的考查,题目难度不大,明确原电池的工作原理、构成条件是答题的关键.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
17.25℃时,0.1mol•L-1的NaHC2O4溶液的PH<7,下列关系正确的是( )
| A. | c(H+)<c(OH-) | B. | c(H2C2O4)>c(C2O42-) | ||
| C. | c(H2C2O4)+c(H+)═c(C2O42- )+c(OH-) | D. | c(Na+)+c(H+)═c(HC2O4-)+c(C2O42-)+c(OH-) |
13.有十种物质:①甲烷②苯③聚乙烯④聚乙炔⑤2-丁炔⑥环己烷 ⑦邻二甲苯 ⑧环己烯 ⑨乙醇⑩苯酚 既能使KMnO4酸性溶液褪色,又能与溴水反应使之褪色的是( )
| A. | ①④⑤⑧ | B. | ④⑤⑧⑩ | C. | ②⑤⑦⑧ | D. | ③④⑤⑦⑧ |
10.下列各组中的两种物质作用时,反应条件或反应物用量的改变对生成物没有影响的是( )
| A. | 碳与氧气 | B. | 氢氧化钠溶液与二氧化碳 | ||
| C. | 钠与氧气 | D. | 氢气与氯气 |
17.山梨酸是一种食品添加剂的成分,其结构如图所示,下列说法正确的是( )
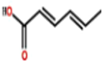

| A. | 该有机物与等物质的量Br2发生加成反应时,可生成两种加成产物 | |
| B. | 该有机物能与金属Na、NaOH溶液、Na2CO3溶液、NaHCO3溶液发生反应 | |
| C. | 该有机物能发生加成、取代、氧化、消去、加聚反应 | |
| D. | 可使用酸性高锰酸钾溶液鉴别该有机物和乳酸(2-羟基丙酸) |
14.结构与物质稳定性有关, 发生消去反应,依据能量观念判断所生成的物质最有可能的是( )
发生消去反应,依据能量观念判断所生成的物质最有可能的是( )

 发生消去反应,依据能量观念判断所生成的物质最有可能的是( )
发生消去反应,依据能量观念判断所生成的物质最有可能的是( )
| A. | 甲物质 | B. | 乙物质 | C. | 丙物质 | D. | 丁物质 |
