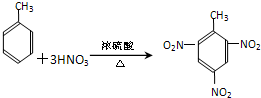
题目内容
将足量的一定质量的铁投入100mL盐酸中,充分反应
后称量剩余的铁,发现铁的质量减少2.80g,请计算(要求有解题过程):
(1)反应生成的氢气在标准状况下的体积;
(2)盐酸的物质的量浓度.
后称量剩余的铁,发现铁的质量减少2.80g,请计算(要求有解题过程):
(1)反应生成的氢气在标准状况下的体积;
(2)盐酸的物质的量浓度.
(1)因参加反应的铁的质量为2.80g,盐酸完全反应,
则设HCl的物质的量为n(HCl),氢气在标准状况下的体积为V(H2),
则Fe+2HCl═FeCl2+H2↑
56g2mol22.4L
2.80g n(HCl)V(H2)
=
=
解得:V(H2)=1.12L,n(HCl)=0.100mol,
答:反应生成的氢气在标准状况下的体积为1.12L;
(2)盐酸的物质的量浓度为
=
=1.00mol?L-1,
答:酸的物质的量浓度为1.00mol/L.
则设HCl的物质的量为n(HCl),氢气在标准状况下的体积为V(H2),
则Fe+2HCl═FeCl2+H2↑
56g2mol22.4L
2.80g n(HCl)V(H2)
| 56g |
| 2.80g |
| 2mol |
| n(HCl) |
| 22.4L |
| V(H2) |
解得:V(H2)=1.12L,n(HCl)=0.100mol,
答:反应生成的氢气在标准状况下的体积为1.12L;
(2)盐酸的物质的量浓度为
| n(HCl) |
| V(溶液) |
| 0.100mol |
| 0.100L |
答:酸的物质的量浓度为1.00mol/L.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目