题目内容
【题目】X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比P电子数多3个,Y、Z均位于第二周期且两元素原子的最外层电子数之和为11,Z、R同主族,M核外电子有26种运动状态,请回答下列问题:
(1)元素M的基态原子的核外电子排布式为_________________。
(2)第一电离能:Y_____(填“ > ”或“<”)Z。
(3)化合物XCl3中心原子的杂化轨道类型为________;RC12的立体构型为_______。
(4)H2Z、H2R的沸点分別为100℃、-60.4℃,试解释其原因:_____________________________。
(5)R、M形成的一种化合物晶胞如图所示。

①该化合物的化学式为_____________。
②若晶胞参数为a pm。列式计算该晶胞的密度ρ=______g·㎝-3。
【答案】 1s22s22p63s23p63d64s2{或[Ar]3d64s2} > sp2 V形 H2O分子间可以形成氢键,H2S分子间不能形成氢键 FeS2 ![]()
【解析】X、Y、Z、R、M是原子序数依次增大五种元素,M核外电子有26种运动状态,则M为Fe;基态X原子的s电子数比p电子数多3个,原子核外电子排布式为1s22s22p1,则X为B元素;Y、Z均位于第二周期且两元素原子的最外层电子数之和为11,则Y为N元素,Z为O元素;Z、R同主族,R为S元素。
(1) M为Fe元素,基态原子的核外电子排布式为1s22s22p63s23p63d64s2,故答案为:1s22s22p63s23p63d64s2;
(2)N元素原子的2p为半充满状态,较为稳定,第一电离能:N>O,故答案为:>;
(3)化合物BCl3中B原子孤电子对数=![]() =0,价层电子对数=3+0=3,其B原子杂化方式为sp2;SCl2分子中S原子价层电子对个数是4且含有2个孤电子对,所以该分子空间构型是V形,故答案为:sp2;V;
=0,价层电子对数=3+0=3,其B原子杂化方式为sp2;SCl2分子中S原子价层电子对个数是4且含有2个孤电子对,所以该分子空间构型是V形,故答案为:sp2;V;
(4)H2O分子间可以形成氢键,H2S分子间不能形成氢键,氢键导致物质的熔沸点升高,所以水的熔沸点高于硫化氢,故答案为:H2O分子间可以形成氢键,H2S分子间不能形成氢键;
(5)①Fe与S形成的化合物中,黑色球个数为4、白色球个数=1+8×![]() =2,则黑色球与白色球个数之比为2:1,所以其化学式为FeS2,故答案为:FeS2;
=2,则黑色球与白色球个数之比为2:1,所以其化学式为FeS2,故答案为:FeS2;
②ρ=![]() =
=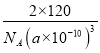 gcm-3=
gcm-3=![]() gcm-3,故答案为:
gcm-3,故答案为: ![]() 。
。

 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
