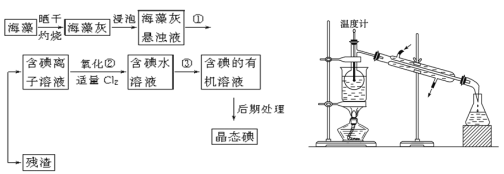
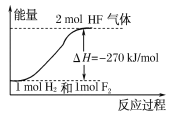
题目内容
【题目】下表为元素周期表的一部分,列出了10种元素在元素周期表中的位置。试回答下列问题:

(1)写出表中⑥含有8个中子的原子的化学符号 ,元素⑦的氢化物与⑧的单质反应的离子方程式为 。
(2)元素⑩的核外电子排布式 。
(3) 根据元素周期表来比较④和Cs的金属性,要通过另一种元素作中介或桥梁进行比较, 这种元素是 (填元素符号)。
(4)据报道,美国科学家卡尔·克里斯特于1998年11月根据①合成了一种名为“N5”的物质,由于其极强的爆炸性,又称“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排列成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键,则“N5”分子碎片的电子式为:__________________。
【答案】(1)146C ,Cl2+H2O=H++Cl-+HClO
(2)1s22s22p63s23p63d64s2
(3)![]() 或 Ba(4)
或 Ba(4)![]()
【解析】试题分析:(1)⑥是碳元素,含有6个质子、8个中子,质量数是14,,原子的化学符号146C,元素⑦是氧元素,氢化物是水;⑧是氯元素,氯气与水反应的离子方程式为Cl2+H2O=H++Cl-+HClO;(2)元素⑩是26号铁元素,核外电子排布式1s22s22p63s23p63d64s2;(3) 根据元素周期表来比较④是镁元素,同周期元素从左到右金属性减弱,Na>Mg,根据同主族从上到下金属性增强,Na< Cs,所以的金属性Mg < Cs;同周期元素从左到右金属性减弱,Cs>Ba,根据同主族从上到下金属性增强,Mg< Ba,所以的金属性Mg < Cs;要通过另一种元素作中介或桥梁进行比较, 这种元素是![]() 或 Ba。
或 Ba。
(4)据报道,美国科学家卡尔·克里斯特于1998年11月根据①合成了一种名为“N5”的物质,由于其极强的爆炸性,又称“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排列成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键,则“N5”分子碎片的电子式为:![]() 。
。

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案