题目内容
(15分) 常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_____________________________________________。
(2)Na2A的水溶液呈______性 ,原因是(用离子方程式表示):____________________
往Na2A溶液中加入 可抑制其水解
A NaOH固体 B 氯化铁固体 C 水 D 碳酸钠固体
已知Ksp(BaA)=1.8×10-10,往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为__________ mol·L-1。(忽略A2—的水解)
(3)若溶液M由2 mol·L-1H2A溶液与2mol·L-1NaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为_____________。
(4)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为____________。
(5)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为__________(填“大于”“等于”“小于”或“均有可能”)。
(1)写出酸H2A的电离方程式_____________________________________________。
(2)Na2A的水溶液呈______性 ,原因是(用离子方程式表示):____________________
往Na2A溶液中加入 可抑制其水解
A NaOH固体 B 氯化铁固体 C 水 D 碳酸钠固体
已知Ksp(BaA)=1.8×10-10,往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为__________ mol·L-1。(忽略A2—的水解)
(3)若溶液M由2 mol·L-1H2A溶液与2mol·L-1NaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为_____________。
(4)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为____________。
(5)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为__________(填“大于”“等于”“小于”或“均有可能”)。
(15分)(1)H2A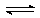 H++HA-,HA-
H++HA-,HA- H++A2-
H++A2-
(2)碱,A2—+H2O HA—+OH— HA—+H2O
HA—+OH— HA—+H2O H2A+OH— AD 5.4×10-10
H2A+OH— AD 5.4×10-10
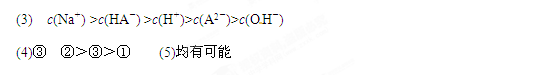
 H++HA-,HA-
H++HA-,HA- H++A2-
H++A2-(2)碱,A2—+H2O
 HA—+OH— HA—+H2O
HA—+OH— HA—+H2O H2A+OH— AD 5.4×10-10
H2A+OH— AD 5.4×10-10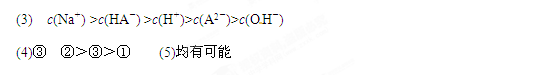
(1)由溶液中存在的各种成分可知:酸H2A为弱酸,所以其电离方程式为:H2A H++HA-,HA-
H++HA-,HA- H++A2-;
H++A2-;
(2)Na2A为强碱弱酸盐,溶液显碱性;原因是A2—+H2O HA—+OH— HA—+H2O
HA—+OH— HA—+H2O H2A+OH—,往Na2A溶液中加入氢氧化钠、碳酸钠可抑制水解;Ksp(BaA)=1.8×10-10,可得往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为5.4×10-10 mol·L-1。
H2A+OH—,往Na2A溶液中加入氢氧化钠、碳酸钠可抑制水解;Ksp(BaA)=1.8×10-10,可得往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为5.4×10-10 mol·L-1。
(3)2 mol·L-1H2A溶液与2mol·L-1NaOH溶液等体积混合,溶液中溶质为NaHA,溶液中离子浓度由大到小顺序为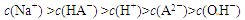 ;
;
(4)种情况的溶液中H2A分子浓度最大的为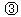 ;pH由大到小的顺序为
;pH由大到小的顺序为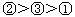
(5)“大于”“等于”“小于”均有可能。
 H++HA-,HA-
H++HA-,HA- H++A2-;
H++A2-;(2)Na2A为强碱弱酸盐,溶液显碱性;原因是A2—+H2O
 HA—+OH— HA—+H2O
HA—+OH— HA—+H2O H2A+OH—,往Na2A溶液中加入氢氧化钠、碳酸钠可抑制水解;Ksp(BaA)=1.8×10-10,可得往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为5.4×10-10 mol·L-1。
H2A+OH—,往Na2A溶液中加入氢氧化钠、碳酸钠可抑制水解;Ksp(BaA)=1.8×10-10,可得往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为5.4×10-10 mol·L-1。(3)2 mol·L-1H2A溶液与2mol·L-1NaOH溶液等体积混合,溶液中溶质为NaHA,溶液中离子浓度由大到小顺序为
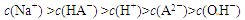 ;
;(4)种情况的溶液中H2A分子浓度最大的为
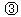 ;pH由大到小的顺序为
;pH由大到小的顺序为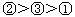
(5)“大于”“等于”“小于”均有可能。

练习册系列答案
相关题目

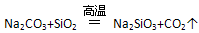 ,说明H2SiO3酸性强于H2CO3
,说明H2SiO3酸性强于H2CO3 、②100ml 0.1 mol/L
、②100ml 0.1 mol/L  两溶液叙述不正确的是
两溶液叙述不正确的是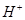 个数:②>①
个数:②>①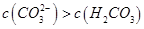
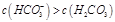
 m
m ol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是 ( )
ol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是 ( ) A2-)
A2-)