题目内容
【题目】实验室有一瓶久置的Na2SO3固体试剂,已部分变质,为测定其纯度,实验设计与操作如下,请回答问題:
(1)Na2SO3变质的原因(用化学方程式表示)___________。
(2)取一定量的样品溶于水,加入过量的BaCl2溶液,然后过滤(如图)、洗涤、干燥、称量,其中洗涤沉淀的具体操作为___________。
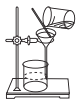
(3)实验时用BaCl2比用CaCl2好,写出两点理由:___________。
【答案】 2Na2SO3+O2=2Na2SO4 用玻璃棒引流,往漏斗中加入蒸馏水,浸没沉淀物,让水自然流下,重复2~3次 一是用BaCl2作沉淀剂,BaSO4、BaSO3的相对分子质量大,生成沉淀质量大,称量误差小;二是用CaCl2作沉淀剂,CaSO4微溶,有误差。
【解析】(1)本题考查Na2SO3的性质,Na2SO3中S显+4价,以还原性为主,容易被氧气氧化成Na2SO4,即化学反应方程式为2Na2SO3+O2=2Na2SO4;(2)考查实验基本操作,洗涤沉淀的方法是:用玻璃棒引流,往漏斗中加入蒸馏水,浸没沉淀物,让水自然流下,重复2~3次;(3)考查沉淀剂的选择,用BaCl2作沉淀剂,因为Ba的相对原子质量大于Ca,因此有BaSO4、BaSO3的相对分子质量大,生成沉淀质量大,称量误差小;用CaCl2作沉淀剂,CaSO4微溶,有误差。

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目