题目内容
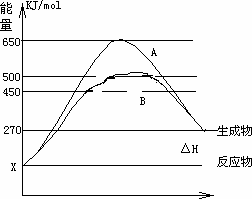
(1)已知:
Fe(s)+1/2O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
2Al(s)+3/2O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
Al和FeO发生铝热反应的热化学方程式是:________.
(2)由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,若1 g水蒸气转化成液态水时放热2.444 KJ,试写出氢气燃烧热的热化学方程式________.
答案:

练习册系列答案
 培优三好生系列答案
培优三好生系列答案
相关题目
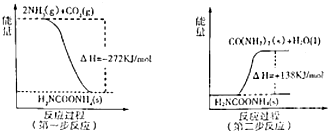
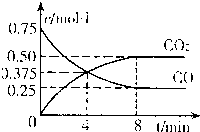 (2010?潍坊一模)铁元素及其化合物与人类的生产生活息息相关,
(2010?潍坊一模)铁元素及其化合物与人类的生产生活息息相关,