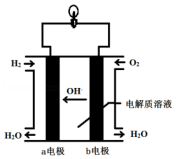
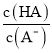题目内容
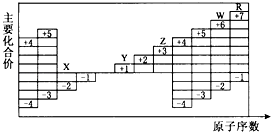
【题目】短周期元素W、X、Y、Z分别属于三个周期,其原子序数依次增大,Y的原子半径是短周期主族元素中最大的.由W、X、Y、Z组成的物质之间存在下图所示的转化关系,其中m是元素Y的单质,n是元素Z的单质,通常为黄绿色气体,s的水溶液常用作漂白剂和消毒剂. 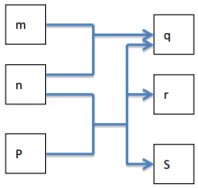
请回答下列问题:
(1)Y的元素符号是 . 常温时Z的最高价氧化物对应水化物的水溶液pH7(填 大于、小于或等于).
(2)X的元素符号是 , 它位于元素周期表中第周期第族,它与同主族相邻元素相比,非金性更强的是 , 能说明这一强弱关系的事实是 .
(3)r的化学式是 , p中存在的化学键类型是 . 用电子式表示q的形成过程 .
(4)n与p反应的化学方程式是 , 该反应中2mol n完全反应时转移电子的数目是NA .
【答案】
(1)Na;小于
(2)O;二;VIA;O;H2O比H2S更稳定
(3)H2O;共价键和离子键;![]()
(4)Cl2+2NaOH=NaCl+NaClO+H2O;2
【解析】解:Y的原子半径是短周期主族元素中最大的,则Y为Na,m是元素Y的单质,故m为Na,n是元素Z的单质,通常为黄绿色气体,则n为Cl2 , Z为Cl元素,m为Na,n为Cl2 , 则生成p为NaCl,为s的水溶液常用作漂白剂和消毒剂,则s中含有ClO﹣ , 且n+p=q+r+s,即Cl2+p=NaCl+s+r(s中含ClO﹣),则为Cl2+2NaOH=NaCl+NaClO+H2O,故p为NaOH,s为NaClO,r为H2O,结合短周期主族元素W、X、Y、Z原子序数依次增大可知,W为H、X为O、Y为Na、Z为Cl,(1)(1)Y的元素符号是Na;Z的最高价氧化物对应水化物为HClO4 , 故pH小于7,所以答案是:Na;小于;(2)X的元素符号是O;故是第二周期第VIA族元素;在元素周期表中越往上越往右非金属性越强,故与同主族相邻元素相比,非金性更强的是O;能说明这一强弱关系的事实是H2O比H2S更稳定;所以答案是:O;二;VIA;O;H2O比H2S更稳定;(3)r的化学式是H2O;p为NaOH,其中氧原子和氢原子之间结合的作用力是共价键,钠离子和氢氧根离子之间之间结合的作用力是离子键,故化学键类型是共价键和离子键;q为NaCl其形成过程为 ![]() ;所以答案是:H2O;共价键和离子键;
;所以答案是:H2O;共价键和离子键; ![]() ;(4)n为Cl2 , p为NaOH,故n与p反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;
;(4)n为Cl2 , p为NaOH,故n与p反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;
Cl2+2NaOH=NaCl+NaClO+H2O~ | 1mole﹣ |
1 | 1 |
2 | 2 |
n(e﹣)=2mol,N(e﹣)=2mol×NA=2NA ,
所以答案是:Cl2+2NaOH=NaCl+NaClO+H2O;2.

 快乐5加2金卷系列答案
快乐5加2金卷系列答案