题目内容
【题目】向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L﹣1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
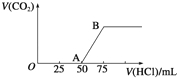
A.OA段所发生反应的离子方程式:H++OH﹣═H2O;CO32﹣+H+═HCO3-
B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
C.产生的CO2体积(标准状况下)为0.056 L
D.原NaOH溶液的物质的量浓度为0.5 mol·L﹣1
【答案】D
【解析】
试题分析:根据图像可知产生CO2消耗盐酸的体积是25mL,而之前消耗盐酸是50mL。由于碳酸钠与盐酸反应时首先转化为碳酸氢钠,然后碳酸氢钠再与盐酸反应放出CO2,方程式为CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑。根据方程式可判断溶液中还含有氢氧化钠,即前25mL盐酸中和氢氧化钠,后25mL盐酸与碳酸钠反应,最后25mL盐酸与碳酸氢钠反应。A.根据以上分析可知OA段所发生反应的离子方程式:H++OH-=H2O、CO32-+H+=HCO3-,A正确;B.根据以上分析可知NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1∶1,B正确;C.产生的CO2消耗的盐酸物质的量是0.025L×0.1mol/L=0.0025mol,则根据方程式HCO3-+H+=H2O+CO2↑可知放出CO2是0.0025mol,在标准状况下的体积为0.0025mol×22.4L/mol=0.056 L,C正确;D.反应结束后溶液中氯化钠的物质的量是0.075L×0.1mol/L=0.0075mol,根据钠离子守恒可知原NaOH溶液的物质的量浓度为0.0075mol ÷0.01L=0.75 mol·L-1,D错误,答案选D。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】近来会宁县区的空气污染指数居高不下,雾霾天气严重,据分析霾中含有硫和氮的氧化物,如SO2、NOx等。
(1)NOx是汽车尾气中的主要污染物之一。
①NOx形成的酸雨被称为硝酸型酸雨,硝酸型酸雨中含有的主要离子有 ;浓硝酸发黄的原因(用化学方程式解释) 。
②汽车发动机工作时高温电火花会引发N2和O2反应,反应的化学方程式是 。
(2)因SO2的大量排放形成的酸雨被称为硫酸型酸雨,我国的酸雨主要是硫酸型酸雨。取硫酸型酸雨样品置于空气中,一段时间后发现该酸雨的酸性增强了,你认为原因是: (用化学方程式表示) 。
(3)为减少SO2的排放,常采取一些有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是 。
②下列物质中,可用于吸收烟气中的SO2的最佳溶液是 (填序号)。
a.Na2CO3b.H2SO4c.NaHSO3d.NH3·H2O
(4)取某空气样本用蒸馏水处理制成待测液,其中所含的离子及其浓度如下:
离子 | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | a | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算: a= mol/L。