题目内容
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O
试通过计算和推理完成下面的问题:
(1)SO2物质可以使酸性KMnO4溶液褪色,此反应中(填写化学式)失去电子.
(2)足量的铜片与 含溶质1.8mol的浓H2SO4充分反应,如果该反应过程中转移了 0.2mol电子,生成的CuSO4的质量为克,生成的气体在标准状况下体积为升(假设气体全部逸出).
(3)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应.请写出此过程发生的反应的离子方程式: .
【答案】
(1)SO2
(2)16,2.24
(3)Ba2++SO42﹣+2OH﹣+2H+=2H2O+BaSO4↓、Ba2++SO42﹣+2OH﹣+Cu2+=Cu(OH)2↓+BaSO4↓
【解析】解:(1)该反应中酸性高锰酸钾溶液作氧化剂,二氧化硫作还原剂,还原剂失电子、氧化剂得电子,所以该反应中SO2失电子,
所以答案是:SO2;
(2)根据转移电子守恒得溶解n(Cu)= ![]() =0.1mol,根据Cu原子守恒得n(CuSO4)=n(Cu)=0.1mol,硫酸铜质量=nM=0.1mol×160g/mol=16g,根据转移电子守恒得二氧化硫气体体积=
=0.1mol,根据Cu原子守恒得n(CuSO4)=n(Cu)=0.1mol,硫酸铜质量=nM=0.1mol×160g/mol=16g,根据转移电子守恒得二氧化硫气体体积= ![]() =2.24L,
=2.24L,
所以答案是:16;2.24;
(3)溶液中含有硫酸铜、硫酸,硫酸铜和硫酸都能和氢氧化钡反应生成硫酸钡沉淀,离子方程式分别为Ba2++SO42﹣+2OH﹣+2H+=2H2O+BaSO4↓、Ba2++SO42﹣+2OH﹣+Cu2+=Cu(OH)2↓+BaSO4↓,
所以答案是:Ba2++SO42﹣+2OH﹣+2H+=2H2O+BaSO4↓、Ba2++SO42﹣+2OH﹣+Cu2+=Cu(OH)2↓+BaSO4↓.

【题目】某化学兴趣小组发现实验室有多件表面呈灰绿色的金属制品,经了解其来源并查阅相关资料(如下表),初步确认为铜制品.
紫铜 | 青铜 | 铜绿 | |
主要成分 | 纯铜 | 铜锡合金 | Cu2(OH)2CO3 |
性质与用途 | 紫红色,质软,导电性能良好;主要用作电线电缆. | 多呈灰绿色,熔点低、硬度大、可塑性强;可铸造成各种器具. | 不溶于水的灰绿色粉末,溶于酸,加热易分解;可作颜料、杀虫剂. |
针对铜制品表面的灰绿色物质究竟是什么,同学们提出了多种猜想并展开实验探究.
(1)【猜想假设】
小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[Cu2(OH)2CO3];
除上述猜想外,其他合理的猜想是(只写一个).
(2)【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆.其判断依据是 .
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧.将表面刮净后的铜制品也投入盐酸中,并无气体产生.由此证明该铜制品不是青铜,理由是 .
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[Cu2(OH)2CO3].于是按如图所示装置进行实验. 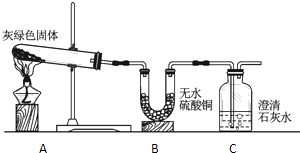
实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了的现象,C中观察到了的现象.
B中所发生反应的化学方程式为: .
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是 .
(5)【实验拓展】
小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为: .