题目内容
【题目】元素的电负性用来描述不同元素的原子对键合电子吸引力的大小。电负性应用:
判断元素的金属性和非金属性的强弱。下表列出了同周期的几种短周期元素的部分性质
请回答下列问题:

(l)写出D元素的离子结构示意图_______________;
(2)X的值应为____(填字母);
A.3.6 B.3.1 C.1.4 D.2.1
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系:________________________________;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:__________________
(用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:____。
【答案】 Al3+ 结构示意图 (见右图)  D 同周期元素的原子半径越小,电负性越大。 HCl > H2S > PH3 Al(OH)3 + 3HClO4 === Al(ClO4)3 + 3H2O
D 同周期元素的原子半径越小,电负性越大。 HCl > H2S > PH3 Al(OH)3 + 3HClO4 === Al(ClO4)3 + 3H2O
【解析】由图可知:A、B、C、D、E分别是Cl、S、P、Al、Na。则(1)Na元素的离子结构示意图为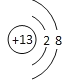 ;(2)同周期元素电负性逐渐增大。所以X的值应该大于1.5小于2.5,所以选D。(3)同周期元素的原子半径越小,电负性越大;(4)非金属性越强,氢化物的稳定性就越强,所以HCl > H2S > PH3;(5) A、D最高价氧化物对应水化物分别为HClO4和Al(OH)3,则反应的化学方程式为:Al(OH)3 + 3HClO4=Al(ClO4)3 + 3H2O。
;(2)同周期元素电负性逐渐增大。所以X的值应该大于1.5小于2.5,所以选D。(3)同周期元素的原子半径越小,电负性越大;(4)非金属性越强,氢化物的稳定性就越强,所以HCl > H2S > PH3;(5) A、D最高价氧化物对应水化物分别为HClO4和Al(OH)3,则反应的化学方程式为:Al(OH)3 + 3HClO4=Al(ClO4)3 + 3H2O。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


