题目内容
已知25 ℃时部分弱电解质 的电离平衡常数数据如表所示,回答下列问题:
的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 |
|
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1 mol·L-1的下列四种溶液,pH由小到大排列的顺序是 (用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1 mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填字母)。
A.c(H+)
B.
C.c(H+)·c(OH-)
D.
E.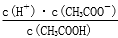
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式 。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)= (填准确数值)。
(5)25℃时,将a mol·L-1的醋酸与b mol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为_________。
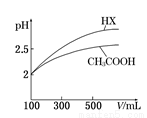
(6)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如右图所示,则HX的电离平衡常数___________(填“>”、”=”或“<”)CH3COOH的电离平衡常数。
(7)标准状况下,将1.12 L CO2通入100 mL 1 mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+_____________________。
②c(H+)+c(Na+)=________________________。
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合化学和生物学科的知识,回答下列问题。
配料表 | 精制海盐、碘酸钾 |
含碘量 | 20~40mg/kg |
卫生许可证号 | ××卫碘字(1999)第001号 |
分装日期 | 见封底 |
储藏方法 | 密封、避光、防潮 |
食用方法 | 烹调时,待食品熟后加入碘盐 |
(1)要在食盐中加碘,是因为碘是人体内合成____________激素的主要原料,缺碘会引起疾病。
(2)食盐中加碘,这碘指的是 (填化学式),其中碘元素的化合价为______________。
(3)根据含碘盐的食用方法,可推测碘酸钾在受热时容易___________________。
 HClO
HClO

 2Fe3++3H2↑
2Fe3++3H2↑ 散到液体分散剂中,所得混合物具有的性质是
散到液体分散剂中,所得混合物具有的性质是
 5.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。
5.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。 为15.55 g。
为15.55 g。