��Ŀ����
����Ŀ��X��Y��Z��W�������ֶ�����Ԫ�أ�
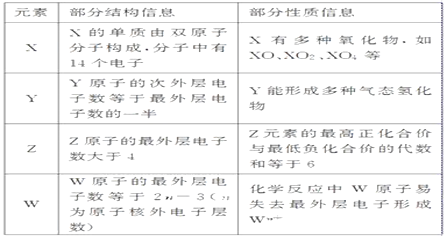
�й����ǵIJ��ֽṹ��Ϣ��������Ϣ�����ʾ���밴Ҫ��ش��������⣺
(1)Z��Ԫ�����ڱ��е�λ����________________��
(2)X��Y����̬�⻯����ȶ�����ǿ������˳����______________(�û�ѧʽ��ʾ)��
(3)X��Y��Z����Ԫ�ص�����������Ӧˮ�����������ǿ������˳����____________________(�û�ѧʽ��ʾ)��
(4)ʵ������X����̬�⻯���ˮ��Һ��ȡW����������ķ�����______________________(�����ӷ���ʽ��ʾ)��
(5)д��Z�ĵ������������Ļ������ͨ��ˮ����������Ӧ�����ӷ���ʽ__________________��
���𰸡� �������ڢ�A�� NH3>CH4 HClO4>HNO3>H2CO3 Al3����3NH3��H2O===Al(OH)3����3NH![]() Cl2��SO2��2H2O===4H����2Cl����SO
Cl2��SO2��2H2O===4H����2Cl����SO![]()
��������X��Y��Z��W�Ƕ����ڵ�����Ԫ��,X�ĵ�����˫ԭ�ӷ��ӹ���,��������14������,��������Ϊ7,X�ж���������,��XO��XO2��X2O4��,����XΪNԪ����Yԭ�ӵĴ�������������������������һ��,Y���γɶ�����̬�⻯��,��YΪCԪ���� Zԭ�ӵ���������������4,���ڷǽ���Ԫ��,ZԪ�ص���������ϼ���������ϼ۴����͵���6,�����Ϊ+7��,ΪClԪ����Wԭ�ӵ���������������![]() Ϊԭ�Ӻ�����Ӳ���),��ѧ��Ӧ��Wԭ����ʧȥ���������γ�
Ϊԭ�Ӻ�����Ӳ���),��ѧ��Ӧ��Wԭ����ʧȥ���������γ�![]() ,
,![]() ����,��WΪAl��
����,��WΪAl��
(1) Cl�ĺ˵����Ϊ17����Ԫ�����ڱ��е�λ���ǵ������ڢ�A�壻��ȷ�𰸣��������ڢ�A�塣
(2) X��Y����̬�⻯��ֱ�Ϊ��NH3��CH4��ͬһ���ڣ������ҷǽ�������ǿ���⻯���ȶ�����ǿ������ȶ���NH3>CH4����ȷ�𰸣� NH3>CH4��
(3)X��Y��Z����Ԫ�ص�����������Ӧˮ����ֱ�ΪHNO3��H2CO3��HClO4��Ԫ�صķǽ���Խǿ������������Ӧˮ��������Խǿ���ǽ����ԣ�Cl>N>C����������HClO4>HNO3>H2CO3����ȷ�𰸣�HClO4>HNO3>H2CO3��
(4) N��̬�⻯���ˮ��ҺΪ��ˮ��ʵ�������Ȼ����Ͱ�ˮ��Ӧ�Ʊ�Al(OH)3�����ӷ���ʽΪ��Al3����3NH3��H2O===Al(OH)3����3NH![]() ����ȷ�𰸣�Al3����3NH3��H2O===Al(OH)3����3NH
����ȷ�𰸣�Al3����3NH3��H2O===Al(OH)3����3NH![]() ��
��
(5)��������ǿ�����ԣ���ˮ��Һ���ܹ��Ѷ�����������Ϊ��������ӣ����ӷ���ʽ��Cl2��SO2��2H2O===4H����2Cl����SO![]() ����ȷ��: Cl2��SO2��2H2O===4H����2Cl����SO
����ȷ��: Cl2��SO2��2H2O===4H����2Cl����SO![]() ��
��




